题目内容
19.25°C时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线 ac所示,下列判断错误的是( )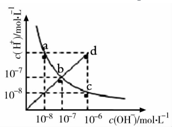
| A. | ac曲线上的任意一点都有c(H+)×c(OH-)=10-14 | |
| B. | CH3COONa溶液不可能位于c点 | |
| C. | d点对应溶液的温度高于25°C,PH<7 | |
| D. | bd线段上任意一点对应的溶液都呈中性 |
分析 A.a、c两点温度相同,水的离子积不变,根据b点氢离子、氢氧根离子浓度可知水的离子积为c(H+)•c(OH-)=10-14;
B.c点氢氧根离子浓度大于氢离子浓度,溶液为碱性,醋酸钠为碱性溶液;
C.水的电离为吸热反应,温度越高,水的电离程度越大;
D.b、d线段上的任意一点都满足c(H+)=c(OH-),溶液显示中性.
解答 解:A.a c曲线上的任意一点,由于温度相同,所以水的离子积相同,根据b点可知,c(H+)•c(OH-)=10-14,故A正确;
B.在c点c(H+)=1×10-8mol/L,c(OH-)=1×10-6mol/L,溶液显示碱性,而醋酸钠溶液显示碱性,所以c点可能为醋酸钠溶液,故B错误;
C.d点时,c(H+)=c(OH-)=1×10-6mol/L>1×10-7mol/L,溶液的pH=6,水的电离为吸热反应,所以d点温度高于25℃,故C正确;
D.b、d线上任意点都满足c(H+)=c(OH-),溶液一定显示中性,故D正确;
故选B.
点评 本题考查了水的电离及影响因素,题目难度不大,注意明确影响水的电离的因素,明确溶液酸碱性取决于溶液中氢离子与氢氧根离子的浓度大小,不能以溶液的pH判断溶液酸碱性.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
6.m g铜与足量浓H2SO4共热时完全反应,收集到n L SO2,则被还原的H2SO4的物质的量是( )
| A. | $\frac{m}{32}$mol | B. | $\frac{m}{64}$mol | C. | $\frac{n}{11.2}$mol | D. | $\frac{n}{22.4}$mol |
10.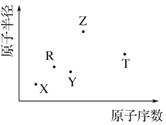 短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
 短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应水化物的酸性:T<R | |
| C. | 氢化物的沸点不一定是:Y>R | |
| D. | 由 X、R、Y、Z 四种元素组成的化合物水溶液一定显碱性 |
7.运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为5KClO3+6P=3P2O5+5KCl.下列有关该反应的叙述不正确的是( )
| A. | KClO3是氧化剂 | B. | P2O5是氧化产物 | ||
| C. | 1molKClO3参加反应有6mole-转移 | D. | 每有6molP被还原,生成5molKCl |
14.在加入铝粉能产生H2的溶液中,下列各组离子可能大量共存的是( )
| A. | NO3-,K+,[Al(OH)4]-,OH- | B. | Na+,Ba2+,Mg2+,HCO3- | ||
| C. | NO3-,Mg2+,K+,Cl- | D. | NH4+,NO3-,CO32-,Na+ |
4.最近我国“人造太阳”研究获重大进展.核聚变中下列质子数小于中子数的原子是( )
| A. | ${\;}_{1}^{2}$H | B. | ${\;}_{1}^{3}$H | C. | ${\;}_{2}^{4}$He | D. | ${\;}_{1}^{1}$H |
11.下列有关乙醇的说法正确的是( )
| A. | 能与H2O发生加成反应 | B. | 能使石蕊试液变红 | ||
| C. | 与CH3OCH3互为同分异构体 | D. | 是食醋的主要成分 |
8.利用湿法炼锌产生的铜镉渣生产金属镉的流程如图:已知铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质.
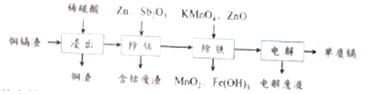
表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算):
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③等.已知浸出的金属离子均为二价,写出浸出钴的化学方程式Co+H2SO4=CoSO4+H2↑
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3等形成微电池产生合金CoSb.该微电池的正极反应式为Sb2O3+Co2++6H++10e-=2CoSb+3H2O
(3)除铁的过程分两步进行,①加入适量KMnO4,发生反应的离子方程式为3Fe2++MnO4-+4H+=3Fe3++MnO2+2H2O,②加入ZnO控制反应液的PH范围为3.3-7.2
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是,若加入的KMnO4不足量,则待电解溶液中有Fe元残余.请设计实验方案加以验证.
(5)净化后的溶液用惰性电极电解可获得镉单质.电解废液中可循环利用的溶质是H2SO4
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Kap(CdCO3)=5.2×10-12
Kap(CdS)=3.6×10-29
Kap(Cd(OH)2)=2.0×10-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是b
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳PH为11,此时溶液中c(Cd2+)=2.0×10-10 mol•L-1.

表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算):
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3等形成微电池产生合金CoSb.该微电池的正极反应式为Sb2O3+Co2++6H++10e-=2CoSb+3H2O
(3)除铁的过程分两步进行,①加入适量KMnO4,发生反应的离子方程式为3Fe2++MnO4-+4H+=3Fe3++MnO2+2H2O,②加入ZnO控制反应液的PH范围为3.3-7.2
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是,若加入的KMnO4不足量,则待电解溶液中有Fe元残余.请设计实验方案加以验证.
(5)净化后的溶液用惰性电极电解可获得镉单质.电解废液中可循环利用的溶质是H2SO4
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Kap(CdCO3)=5.2×10-12
Kap(CdS)=3.6×10-29
Kap(Cd(OH)2)=2.0×10-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是b
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳PH为11,此时溶液中c(Cd2+)=2.0×10-10 mol•L-1.
9.下列说法正确的是( )
| A. | 工业电解精炼铜时,粗铜与外电源的正极相连 | |
| B. | 常温下向纯水中加入盐酸,水的离子积减小 | |
| C. | 催化剂既能改变化学反应速率,也能改变焓变 | |
| D. | 其它条件不变时,升髙温度,吸热反应的v(正)增大,v(逆)减小 |