题目内容
16.有两种二元弱酸H2A与H2B.酸性强弱顺序为:酸性强弱顺序H2A>H2B>HA->HB-,(已知:H2A.Ka1=1.54×10-2,Ka2=1.02×10-2),下列说法正确的是( )| A. | 等浓度等体积H2A与NaOH的混合溶液呈碱性 | |
| B. | H2A与少量B2-反应的离子方程式为2H2A+B2-=2HA-+H2B | |
| C. | NaHB溶液一定显酸性 | |
| D. | 等浓度等体积的NaHA与Na2B混合,混合溶液中存在这样的关系:c(A2-)>c(B2-)>c(HA-)>c(HB-) |
分析 A.等浓度等体积H2A与NaOH的混合得到NaHA溶液,溶液HA-水解程度和电离程度大小不知不能判断溶液酸碱性;
B.结合酸性强弱顺序H2A>H2B>HA->HB-分析判断反应是否进行;
C.NaHB溶液中HB-离子的电离和水解程度不知不能确定溶液酸碱性;
D.等浓度等体积NaHA 与Na2B 的混合溶液中c(A2-)<c(B2-);
解答 解:A.等浓度等体积H2A与NaOH的混合,得到NaHA溶液,溶液HA-水解程度和电离程度大小不知溶液不一定呈碱性,故A错误;
B.酸性强弱顺序H2A>H2B>HA->HB-,H2A与少量B2-反应的离子方程式为2H2A+B2-=2HA-+H2B,故B正确;
C.NaHB溶液中HB-离子电离程和水解程度大小不知不能确定溶液酸碱性,故C错误;
D.酸性强弱顺序H2A>H2B>HA->HB-,等浓度等体积NaHA 与Na2B 的混合溶液中c(A2-)<c(B2-),故D错误;
故选B.
点评 本题考查了弱电解质电离平衡的分析应用,主要是盐类水解和对应酸的酸性强弱应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
7.下列溶液中物质的量浓度为1mol/L的是( )
| A. | 将40gNaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L 10 mol/L的浓盐酸与9L水混合 | |
| D. | 将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
4.可以用于除去乙烷中的少量乙烯的试剂是( )
| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 溴化钠溶液 | D. | 浓硫酸 |
11.同质量的锌与稀硫酸反应,欲使反应速率最大,选择下列组合中的反应条件( )
①锌粒 ②芯片 ③锌粉 ④10%的稀硫酸 ⑤15%的稀硫酸 ⑥20%的稀硫酸
⑦加热 ⑧用水冷却 ⑨不断搅拌 ⑩迅速加入锌片后静置.
①锌粒 ②芯片 ③锌粉 ④10%的稀硫酸 ⑤15%的稀硫酸 ⑥20%的稀硫酸
⑦加热 ⑧用水冷却 ⑨不断搅拌 ⑩迅速加入锌片后静置.
| A. | ③⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑥⑦⑨ | D. | ③⑤⑦⑨ |
8.有关甲、乙、丙、丁四个图示的叙述正确的是( )

| A. | 甲中负极反应式为Ag++e-═Ag | |
| B. | 丙中H+向碳棒方向移动 | |
| C. | 乙中阳极反应式为2H++2e-═H2↑ | |
| D. | 丁中电解开始时阳极产生黄绿色气体 |
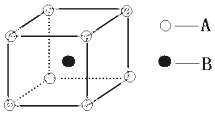 根据离子晶体的晶胞结构,判断下列离子晶体的化学式:AB(A表示阳离子,B表示阴离子).
根据离子晶体的晶胞结构,判断下列离子晶体的化学式:AB(A表示阳离子,B表示阴离子).