题目内容
7.下列溶液中物质的量浓度为1mol/L的是( )| A. | 将40gNaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L 10 mol/L的浓盐酸与9L水混合 | |
| D. | 将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
分析 A.体积指溶液体积不是溶剂体积;
B.根据温度、压强对气体摩尔体积的影响分析判断;
C.根据不同液体混合时体积能否直接加和判断;
D.质量换算物质的量,依据浓度概念计算得到.
解答 解:A.体积指溶液体积不是溶剂体积,所以40gNaOH溶解于1L水中配成的NaOH溶液浓度不是1mol/L,故A错误;
B.气体摩尔体积受温度和压强的影响,温度越高,气体摩尔体积越大,标况下,22.4LHCl的物质的量是1mol,常温常压下,22.4LHCl的物质的量小于1mol,所以常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液的物质的量浓度不是1mol/L,故B错误;
C.1L10mol/L的浓盐酸与9L水混合配成溶液的体积不是10L,所以混合后溶液的物质的量浓度不是1mol/L,故C错误;
D.10gNaOH物质的量为0.25mol,溶解后配制为250ml的溶液,其浓度为1 mol•L-1,故D正确.
故选D.
点评 本题考查了溶液浓度的计算应用,主要是溶液混合后体积变化的判断,浓度概念的理解分析,题目难度中等.

练习册系列答案
相关题目
18.室温下,向100mL 0.1mol/L的H2SO4中加入足量的锌粒,若想减慢制取H2的速率,但又不影响H2的体积,向硫酸溶液中加入试剂可以选( )
①硝酸钠溶液 ②醋酸钠溶液③碳酸钠溶液 ④氯化钠溶液.
①硝酸钠溶液 ②醋酸钠溶液③碳酸钠溶液 ④氯化钠溶液.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
12.下列物质不能把含有酸性Fe2+的溶液氧化成Fe3+的是( )
| A. | 新制氯水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 往溶液中通入氧气 | D. | 往溶液中加入铁粉 |
16.有两种二元弱酸H2A与H2B.酸性强弱顺序为:酸性强弱顺序H2A>H2B>HA->HB-,(已知:H2A.Ka1=1.54×10-2,Ka2=1.02×10-2),下列说法正确的是( )
| A. | 等浓度等体积H2A与NaOH的混合溶液呈碱性 | |
| B. | H2A与少量B2-反应的离子方程式为2H2A+B2-=2HA-+H2B | |
| C. | NaHB溶液一定显酸性 | |
| D. | 等浓度等体积的NaHA与Na2B混合,混合溶液中存在这样的关系:c(A2-)>c(B2-)>c(HA-)>c(HB-) |
17.以下实验装置一般不用于分离物质的是( )
| A. |  | B. |  | C. |  | D. |  |
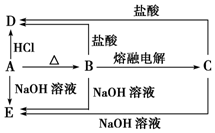 A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.
A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.