题目内容
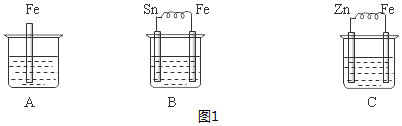
5.用所学的电化学知识回答下列问题:Ⅰ.如图烧杯中都盛有稀硫酸,依次分析(1)~(4)小题.
(1)B中负极反应式为:Fe-2e-=Fe2+;
(2)C中溶液的pH增大(填“增大”、“减小”或“不变”);
(3)三烧杯中铁被腐蚀的速率由快到慢的顺序是B>A>C;
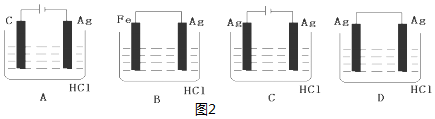
(4)某学生欲完成2HCl+2Ag=2AgCl+H2↑反应,设计了下列四个实验,你认为可行的实验是C.
分析 (1)B装置构成原电池,Fe易失电子作负极、Sn作正极,负极Fe失电子发生氧化反应;
(2)C装置构成原电池,Zn易失电子作负极、Fe作正极,正极上氢离子得电子发生还原反应而生成氢气,导致氢离子浓度降低;
(3)作负极的金属>发生化学腐蚀的金属>作正极的金属;
(4)盐酸和银不能自发的进行氧化还原反应,所以不能设计成原电池,只能设计成电解池,失电子的物质作电解池阳极,金属或导电的非金属作电解池阴极,失电子的物质作电解质溶液.
解答 解:(1)B装置构成原电池,Fe易失电子作负极、Sn作正极,负极Fe失电子发生氧化反应,负极反应式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(2)C装置构成原电池,Zn易失电子作负极、Fe作正极,正极上氢离子得电子发生还原反应而生成氢气,电极反应式为2H++2e-=H2↑,导致氢离子浓度降低,溶液的pH增大,故答案为:增大;
(3)金属腐蚀快慢速率:作负极的金属>发生化学腐蚀的金属>作正极的金属,所以铁被腐蚀快慢速率为B>A>C,
故答案为:B>A>C;
(4)2HCl+2Ag=2AgCl↓+H2↑不能自发进行,所以必须设计成电解池,该反应中银失电子,所以银作电解池阳极,金属或导电的非金属作电解池阴极,该反应中氯化氢得电子生成氢气,则选取盐酸作电解质溶液,所以C选项符合条件,
故选C.
点评 本题考查原电池原理,正确判断正负极并会书写电极反应式,知道金属被腐蚀快慢速率,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
16.有两种二元弱酸H2A与H2B.酸性强弱顺序为:酸性强弱顺序H2A>H2B>HA->HB-,(已知:H2A.Ka1=1.54×10-2,Ka2=1.02×10-2),下列说法正确的是( )
| A. | 等浓度等体积H2A与NaOH的混合溶液呈碱性 | |
| B. | H2A与少量B2-反应的离子方程式为2H2A+B2-=2HA-+H2B | |
| C. | NaHB溶液一定显酸性 | |
| D. | 等浓度等体积的NaHA与Na2B混合,混合溶液中存在这样的关系:c(A2-)>c(B2-)>c(HA-)>c(HB-) |
13.已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1269kJ/mol下列说法正确的是( )
| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448 kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6 kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H-O键比H-N键弱 |
10.下列物质属于电解质的是( )
| A. | 氨水 | B. | 食醋 | C. | 胆矾 | D. | 酒精 |
17.以下实验装置一般不用于分离物质的是( )
| A. |  | B. |  | C. |  | D. |  |
14.向NaBr、NaI、Na2CO3的混合溶液中通入足量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物的组成可能是( )
| A. | NaCl | B. | NaCl、Na2CO3 | C. | NaCl、I2 | D. | NaCl、NaI、Na2CO3 |
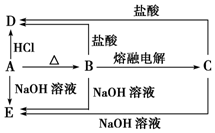 A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.
A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水. 质
质