题目内容
4.下列图示与对应的叙述错误的是( )| A. | 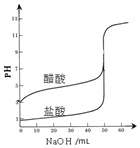 表示分别用NaOH溶液滴定等浓度等体积的盐酸和醋酸溶液反应变化曲线,指示剂都可用酚酞 | |
| B. |  表示分别用等浓度AgNO3溶液滴定等浓度等体积的NaCl、NaBr及NaI溶液反应变化曲线,c为I- | |
| C. | 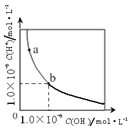 表示一定温度下,水溶液中H+和OH-的浓度变化曲线,b→a可能是加CuCl2溶液导致的 | |
| D. | 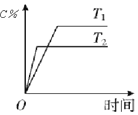 表示其他条件不变时,可逆反应A(g)+3B(g)?2C(g)△H<0,C的物质的量分数与温度的关系 |
分析 A.醋酸为弱酸,等浓度时pH比盐酸大,滴定终点呈碱性;
B.PX的值越大,代表该离子的浓度越小;
C.b→a,氢离子浓度增多,氢氧根离子浓度减小;
D.正反应为放热反应,升高温度,平衡逆向移动.
解答 解:A.醋酸为弱酸,等浓度时pH比盐酸大,滴定终点呈碱性,可用酚酞作指示剂,故A正确;
B.AgI的溶度积最小,且PX=-lg[c(X-)]的值越大,代表该离子的浓度越小,可知c为Cl-的曲线,故B错误;
C.氯化铜水解呈酸性,且易与氢氧根离子反应生成程度,b→a,氢离子浓度增多,氢氧根离子浓度减小,曲线符合,故C正确;
D.正反应为放热反应,升高温度,平衡逆向移动,C的物质的量分数减小,故D正确.
故选B.
点评 本题涉及知识点较多,为考试热点和常见题型,侧重考查学生的分析能力,根据弱电解质溶液中的电离平衡、盐的水解等知识来分析解答,题目难度中等.

练习册系列答案
相关题目
20.下列离子方程式正确的是( )
| A. | 硫酸钙悬浊液中加入碳酸钠:CaSO4(s)+CO32-(aq)═CaCO3(s)+SO42-(aq) | |
| B. | 醋酸铵溶于水:CH3COONH4+H2O?CH3COOH+NH3•H2O | |
| C. | 硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:HSO4-+OH-═SO42-+H2O | |
| D. | 碳酸氢钠水解:HCO3-+H2O?H3O++CO32- |
1.下列有机物的化学用语正确的是( )
| A. | CH(CH3)3:表示正丁烷的结构简式 | |
| B. |  :表示四氯化碳的电子式 :表示四氯化碳的电子式 | |
| C. |  表示乙酸的球棍模型(小球表示C、H、O元素) 表示乙酸的球棍模型(小球表示C、H、O元素) | |
| D. | C2H4O:表示乙醇的分子式 |
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 足量的铁粉与200 mL 1 mol•L-1的硝酸完全反应,生成H2的分子数为0.1NA | |
| C. | 0.1 mol Cl2通入含0.1 mol FeBr2的溶液中,被氧化的溴离子数为0.2NA | |
| D. | 标准状况下,2.24 L NO和足量O2反应,生成的NO2分子数为0.1NA |
19.下列物质与其用途完全符合的有( )
①Na2CO3-制水泥
②SiO2-太阳能电池
③AgI-人工降雨
④MgCl2-制 Mg
⑤A12O3-焊接钢轨
⑥NaClO-消毒剂
⑦H2SO4-制炸药
⑧Na-制 Ti.
①Na2CO3-制水泥
②SiO2-太阳能电池
③AgI-人工降雨
④MgCl2-制 Mg
⑤A12O3-焊接钢轨
⑥NaClO-消毒剂
⑦H2SO4-制炸药
⑧Na-制 Ti.
| A. | 5 个 | B. | 6 个 | C. | 7 个 | D. | 8个 |
9.在1L浓度为0.2mol•L-1Fe(NO3)3和1.5 mol•L-1H2SO4组成的混合溶液中,加入39.2g铁粉使其充分反应.下列有关说法正确的是( )
| A. | 反应后产生标准状况下的氢气11.2 L | |
| B. | 反应后的溶液中c(Fe2+):c(Fe3+)=2:1 | |
| C. | 反应后的溶液还可以溶解16.8 g铁粉 | |
| D. | 反应后的溶液还可以溶解19.2 g铜 |
16.下列关于乙醇与钠反应的说法不正确的是( )
| A. | 与钠反应的速率:乙醇<水 | |
| B. | O-H的极性:乙醇>水 | |
| C. | O-H的极性受相邻基团的影响 | |
| D. | 依据乙醇与H2物质的量之比2:1,可确定乙醇的结构 |
13.除去下列物质中所含的少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 选项 | 混合物 | 试剂 | 分离方法 |
| A | 苯(苯酚) | NaOH溶液 | 分液 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 乙酸(乙醇) | 金属钠 | 蒸馏 |
| D | C17H35COONa(甘油) | NaCl | 结晶 |
| A. | A | B. | B | C. | C | D. | D |
2.下列关于有机物的说法正确的是( )
| A. | 乙烯能使酸性KMnO4溶液和溴水褪色,二者反应原理相同 | |
| B. | 交警用酸性重铬酸钾溶液检查司机是否饮酒过量时乙醇发生取代反应 | |
| C. | 乙酸的分子式为C2H4O2,属于弱酸 | |
| D. | 苯分子中没有碳碳双键,因此苯不能发生加成反应 |