题目内容
9.在1L浓度为0.2mol•L-1Fe(NO3)3和1.5 mol•L-1H2SO4组成的混合溶液中,加入39.2g铁粉使其充分反应.下列有关说法正确的是( )| A. | 反应后产生标准状况下的氢气11.2 L | |
| B. | 反应后的溶液中c(Fe2+):c(Fe3+)=2:1 | |
| C. | 反应后的溶液还可以溶解16.8 g铁粉 | |
| D. | 反应后的溶液还可以溶解19.2 g铜 |
分析 溶液中n(Fe3+)=0.2mol,n(NO3-)=0.6mol,n(H+)=3mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,由于氧化性为氧化性为HNO3>Fe3+>H+,先发生:Fe+4H++NO3-═Fe3++NO↑+2H2O,0.6molNO3-完全反应消耗0.6molFe,消耗2.4molH+,生成0.6molFe3+、0.6molNO,反应后剩余0.1molFe、0.6molH+,此时溶液中共有0.8molFe3+,再发生:Fe+2Fe3+═3Fe2+,0.1molFe反应消耗0.2molFe3+,生成0.3molFe2+,剩余0.6molFe3+,Fe没有剩余,不发生反应Fe+2H+═Fe2++H2↑,即反应中不会生成氢气,据此进行解答.
解答 解:原溶液中n(Fe3+)=0.2mol,n(NO3-)=0.6mol,n(H+)=3mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,
由于氧化性为氧化性为HNO3>Fe3+>H+,先发生反应:Fe+4H++NO3-═Fe3++NO↑+2H2O,0.6molNO3-完全反应消耗0.6molFe,消耗2.4molH+,生成0.6molFe3+、0.6molNO,反应后剩余0.1molFe、0.6molH+,此时溶液中共有0.8molFe3+,再发生反应:Fe+2Fe3+═3Fe2+,0.1molFe反应消耗0.2molFe3+,生成0.3molFe2+,剩余0.6molFe3+,没有Fe剩余,则不发生反应:Fe+2H+═Fe2++H2↑,即反应中没有氢气生成,
A.根据分析可知,反应中没有氢气生成,故A错误;
B.反应后的溶液中c(Fe2+):c(Fe3+)=n(Fe2+):n(Fe3+)=0.3mol:0.6mol=1:2,故B错误;
C.反应后溶液中能够与Fe反应的离子为0.6molH+、0.6molFe3+,根据反应Fe+2Fe3+═3Fe2+可知,0.6molFe3+能够溶解0.3molFe,根据反应Fe+2H+═Fe2++H2↑可知0.6molH+能够溶解0.3molFe,所以能够溶解的Fe的总质量为:56g/mol×(0.3mol+0.3mol)=33.6g,故C错误;
D.反应后溶液中能够与Cu反应的离子为0.6molFe3+,根据反应Cu+2Fe3+═Cu2++2Fe2+可知,0.6molFe3+能够溶解0.3molCu,溶解的Cu的质量为:64g/mol×0.3mol=19.2g,故D正确;
故选D.
点评 本题考查氧化还原反应的计算、混合物反应的计算,题目难度中等,明确发生反应的实质及先后顺序为解答关键,试题侧重考查学生的分析能力及化学计算能力.

| A. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++HCO3-+2OH-═CO32-+NH3•H2O+H2O | |
| B. | 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 向硅酸钠的溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| D. | 氯气与水反应:Cl2+H2O=2H++C1-+ClO- |
| A. | 氯化钡溶液与硫酸氢钾溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 氢氧化钡溶液与硝酸反应:2H++2OH-═2H2O | |
| C. | 氢氧化钡溶液与硫酸氢钠反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与醋酸反应:CO32-+2H+═CO2↑+H2O |
| A. | 一定条件下乙醇和氧气反应生成乙醛 | |
| B. | 乙烯通入溴水中 | |
| C. | 乙烯合成聚乙烯 | |
| D. | 光照射甲烷和氯气的混合气体 |
| A. | 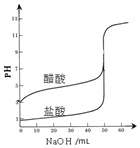 表示分别用NaOH溶液滴定等浓度等体积的盐酸和醋酸溶液反应变化曲线,指示剂都可用酚酞 | |
| B. |  表示分别用等浓度AgNO3溶液滴定等浓度等体积的NaCl、NaBr及NaI溶液反应变化曲线,c为I- | |
| C. | 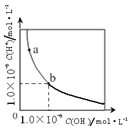 表示一定温度下,水溶液中H+和OH-的浓度变化曲线,b→a可能是加CuCl2溶液导致的 | |
| D. | 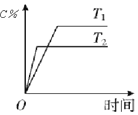 表示其他条件不变时,可逆反应A(g)+3B(g)?2C(g)△H<0,C的物质的量分数与温度的关系 |
| A. | 可用蒸馏的方法除去乙酸中少量的乙醇 | |
| B. | 可选用KOH溶液除去氧化铁中混杂的氧化铝 | |
| C. | 可用过滤的方法除去粗盐溶液中的泥沙 | |
| D. | 可用萃取、分液、蒸馏的方法从稀碘水获得单质碘 |
| A. | 惰性电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2+═4Na++2Cu(OH)2↓+O2↑ | |
| C. | 向NaClO和NaCl混合溶液中滴少量FeSO4溶液:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至沉淀物质的量最大:Al3++2SO42-+2Ba2++4OH-═[Al(OH)4]-+2BaSO4↓ |
①浓硝酸 ②稀氢氧化钠溶液 ③液溴 ④纯碱溶液 ⑤氢氟酸.
| A. | ①③⑤ | B. | ②④ | C. | ①③ | D. | ①②③④⑤ |
| A. | N2、H2、NH3的浓度相等 | |
| B. | 容器内压强不再变化 | |
| C. | 单位时间内消耗a mol N2,同时生成2a mol NH3 | |
| D. | 容器内混合气体密度不再变化 |