题目内容
19.下列物质与其用途完全符合的有( )①Na2CO3-制水泥
②SiO2-太阳能电池
③AgI-人工降雨
④MgCl2-制 Mg
⑤A12O3-焊接钢轨
⑥NaClO-消毒剂
⑦H2SO4-制炸药
⑧Na-制 Ti.
| A. | 5 个 | B. | 6 个 | C. | 7 个 | D. | 8个 |
分析 ①制备水泥原料为石灰水与黏土;
②高纯硅为半导体,常用作制造太阳能电池的原料;
③AgI易与空气中水蒸气结合形成晶核;
④工业上用电解熔融氯化镁方法制取镁;
⑤铝热反应放出大量的热能够熔化钢轨;
⑥NaClO与二氧化碳、水反应生成次氯酸,次氯酸具有强氧化性,能够杀菌消毒;
⑦硫酸可用于制造肥料、药物、炸药、颜料;
⑧钠活泼性强于钛.
解答 解:①制备水泥原料为石灰水与黏土,不需要碳酸钠,故错误;
②高纯硅为半导体,常用作制造太阳能电池的原料,二氧化硅为绝缘体,故错误;
③AgI易与空气中水蒸气结合形成晶核,有利水汽粒子的碰撞增大,从而形成雨,故正确;
④工业上用电解熔融氯化镁方法制取镁,故正确;
⑤铝热反应放出大量的热能够熔化钢轨,可用于焊接钢轨,而不是氧化铝,故错误;
⑥NaClO与二氧化碳、水反应生成次氯酸,次氯酸具有强氧化性,能够杀菌消毒,常用作消毒剂,故正确;
⑦硫酸可以用于制造炸药,故正确;
⑧钠的活泼性强于钛,能够与熔融的氯化钛反应制取钛,故正确;
故物质与其用途完全符合的有5;
故选A.
点评 本题考查常见物质的性质及应用,题目难度不大,注意常见相关基础知识的积累,性质决定用途.

练习册系列答案
相关题目
15.在Cl和Cl-两种粒子中,相同的是( )
| A. | 核内质子数 | B. | 核外电子数 | C. | 最外层电子数 | D. | 核外电子层数 |
16.在不同条件下分别测得反应2A+B?3C的化学反应速率,其中表示该反应进行得最快的是( )
| A. | v(A)=0.4mol/(L•s) | B. | v(B)=0.1mol/(L•s) | C. | v(C)=0.3mol/(L•s) | D. | v(A)=0.3mol/(L•s) |
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L苯所含的碳碳双键数为3NA | |
| B. | 常温常压下,28 g乙烯和丙烯(C3H6)的混合气体中所含氢原子数为4NA | |
| C. | 1 mol金属钠在足量乙醇完全反应转移的电子数为2NA | |
| D. | 1 mol•L-1的醋酸溶液中含醋酸分子数为NA |
14.下列各组混合物中,不能用分液漏斗进行分离的是( )
| A. | 水和溴苯 | B. | 乙酸乙酯和饱和碳酸钠溶液 | ||
| C. | 碘和四氯化碳 | D. | 硝基苯和水 |
4.下列图示与对应的叙述错误的是( )
| A. | 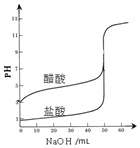 表示分别用NaOH溶液滴定等浓度等体积的盐酸和醋酸溶液反应变化曲线,指示剂都可用酚酞 | |
| B. |  表示分别用等浓度AgNO3溶液滴定等浓度等体积的NaCl、NaBr及NaI溶液反应变化曲线,c为I- | |
| C. | 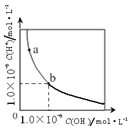 表示一定温度下,水溶液中H+和OH-的浓度变化曲线,b→a可能是加CuCl2溶液导致的 | |
| D. | 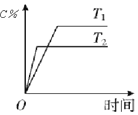 表示其他条件不变时,可逆反应A(g)+3B(g)?2C(g)△H<0,C的物质的量分数与温度的关系 |
11.下列关于化学反应速率的说法正确的是( )
| A. | 对任何化学反应来说,反应速率越大,反应现象就越明显 | |
| B. | 化学反应速率为“0.8mol•L-1•s-1”所表示的意义是:时间为1s时,某物质的浓度为0.8mol•L-1 | |
| C. | 可逆反应达到化学平衡状态时,当正反应速率增大时,逆反应速率会减小 | |
| D. | 对于放热反应,提高反应温度也能增大反应速率 |
8.下列说法正确的是( )
| A. | 实验室保存氯化铁溶液时常加入一根铁钉 | |
| B. | 工业上可用电解熔融的氯化铝制备金属铝 | |
| C. | 盐酸溶液和硫酸铁溶液中水的电离程度均增大 | |
| D. | 当甲烷-氧气-碱性(KOH溶液)燃料电池工作时,通入甲烷一极的电极反应式是:CH4+10OH--8e-═CO32-+7H2O |
17.向含有CaCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是( )
| A. | c(CO32-) | B. | c(Ca2+) | C. | c(H+) | D. | Ksp(CaCO3) |