题目内容
16.下列关于乙醇与钠反应的说法不正确的是( )| A. | 与钠反应的速率:乙醇<水 | |
| B. | O-H的极性:乙醇>水 | |
| C. | O-H的极性受相邻基团的影响 | |
| D. | 依据乙醇与H2物质的量之比2:1,可确定乙醇的结构 |
分析 乙醇含有羟基,可由乙醇与钠反应生成的氢气的量确定,由于乙基给电子能力较弱,可知乙醇的O-H极性比水弱,说明-H的极性受相邻基团的影响,以此解答该题.
解答 解:A.乙醇与水相比较,水与钠反应较为剧烈,故A正确;
B.乙基给电子能力较弱,乙醇的O-H极性比水弱,故B错误;
C.乙醇和水都含有O-H键,两分子中O-H的极性不同,可说明O-H的极性受相邻基团的影响,故C正确;
D.乙醇与H2物质的量之比2:1,可说明乙醇含有羟基,且只有羟基与钠反应生成氢气,故D正确.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,题目侧重于乙醇的考查,注意把握乙醇的结构和性质,易错点为B,注意分子极性的比较,难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案
相关题目
12.目前世界上60%的镁是从海水中提取的.海水提镁的主要流程如下:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 在海水中加入石灰乳的作用是沉淀Mg2+ | |
| B. | 可用电解氯化镁的方法获得镁 | |
| C. | 操作B涉及到加热浓缩(或蒸发结晶)、过滤等操作 | |
| D. | 上述过程中只涉及到氧化还原反应和复分解反应 |
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L苯所含的碳碳双键数为3NA | |
| B. | 常温常压下,28 g乙烯和丙烯(C3H6)的混合气体中所含氢原子数为4NA | |
| C. | 1 mol金属钠在足量乙醇完全反应转移的电子数为2NA | |
| D. | 1 mol•L-1的醋酸溶液中含醋酸分子数为NA |
4.下列图示与对应的叙述错误的是( )
| A. | 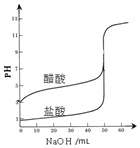 表示分别用NaOH溶液滴定等浓度等体积的盐酸和醋酸溶液反应变化曲线,指示剂都可用酚酞 | |
| B. |  表示分别用等浓度AgNO3溶液滴定等浓度等体积的NaCl、NaBr及NaI溶液反应变化曲线,c为I- | |
| C. | 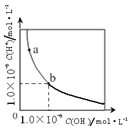 表示一定温度下,水溶液中H+和OH-的浓度变化曲线,b→a可能是加CuCl2溶液导致的 | |
| D. | 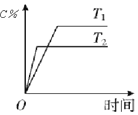 表示其他条件不变时,可逆反应A(g)+3B(g)?2C(g)△H<0,C的物质的量分数与温度的关系 |
11.下列关于化学反应速率的说法正确的是( )
| A. | 对任何化学反应来说,反应速率越大,反应现象就越明显 | |
| B. | 化学反应速率为“0.8mol•L-1•s-1”所表示的意义是:时间为1s时,某物质的浓度为0.8mol•L-1 | |
| C. | 可逆反应达到化学平衡状态时,当正反应速率增大时,逆反应速率会减小 | |
| D. | 对于放热反应,提高反应温度也能增大反应速率 |
1.下列反应的离子方程式书写正确的是( )
| A. | 惰性电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2+═4Na++2Cu(OH)2↓+O2↑ | |
| C. | 向NaClO和NaCl混合溶液中滴少量FeSO4溶液:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至沉淀物质的量最大:Al3++2SO42-+2Ba2++4OH-═[Al(OH)4]-+2BaSO4↓ |
8.下列说法正确的是( )
| A. | 实验室保存氯化铁溶液时常加入一根铁钉 | |
| B. | 工业上可用电解熔融的氯化铝制备金属铝 | |
| C. | 盐酸溶液和硫酸铁溶液中水的电离程度均增大 | |
| D. | 当甲烷-氧气-碱性(KOH溶液)燃料电池工作时,通入甲烷一极的电极反应式是:CH4+10OH--8e-═CO32-+7H2O |
5.下列物质在水溶液中的电离方程式正确的是( )
| A. | HCl═H++Cl- | B. | H2O═H++OH- | ||
| C. | Na2CO3?2Na++CO32- | D. | NH3•H2O═NH4++OH- |
14.NH3是一种重要的化工原料,在生产、生活中用途广泛.

(1)已知:
注:拆开气态物质中1mol某种共价键需要吸收的能量,就是该共价键的键能.
N2 (g)+3H2 (g)?2NH3 (g)△H=-92kJ•mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2+3H2?2NH3,测得各组分浓度随时间变化如图1所示.
①表示c(N2)的曲线是曲线A(填“曲线A”、“曲线B”或“曲线C”).
②0~t0时用H2表示反应速率v(H2)$\frac{0.6}{{t}_{0}}$mol•L-1•min-1.
③下列能说明该反应达到平衡的是a、d
a.混合气体的压强不再变化
b.2c(H2)=3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
①电极b名称是正极.
②电解质溶液中OH-离子向电极a移动(填“电极a”或“电极b”).
③电极a的电极反应式为2NH3+6OH--6e-=N2+6H2O.
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4).该反应的化学反应方程式是2NH3+NaClO=N2H4+NaCl+H2O.

(1)已知:
| 共价键 | 键能/kJ•mol-1 |
| H-H | 436 |
N≡N | 946 |
| N-H | 391 |
N2 (g)+3H2 (g)?2NH3 (g)△H=-92kJ•mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2+3H2?2NH3,测得各组分浓度随时间变化如图1所示.
①表示c(N2)的曲线是曲线A(填“曲线A”、“曲线B”或“曲线C”).
②0~t0时用H2表示反应速率v(H2)$\frac{0.6}{{t}_{0}}$mol•L-1•min-1.
③下列能说明该反应达到平衡的是a、d
a.混合气体的压强不再变化
b.2c(H2)=3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
①电极b名称是正极.
②电解质溶液中OH-离子向电极a移动(填“电极a”或“电极b”).
③电极a的电极反应式为2NH3+6OH--6e-=N2+6H2O.
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4).该反应的化学反应方程式是2NH3+NaClO=N2H4+NaCl+H2O.