题目内容
1.下列化工生产过程中,未涉及氧化还原反应的是( )| A. | 海带提碘 | B. | 氯碱工业 | C. | 海水提溴 | D. | 侯德榜制碱法 |
分析 含元素化合价变化的反应,为氧化还原反应,反之不是,以此来解答.
解答 解:A.碘以离子存在,海水提碘时I元素的化合价升高,发生氧化还原反应,故A不选;
B.氯碱工业中电解饱和食盐水,生成NaOH、氢气、氯气,H、Cl元素的化合价变化,为氧化还原反应,故B不选;
C.海水中溴以离子存在,需要氧化剂氧化,Br元素的化合价升高,发生氧化还原反应,故C不选;
D.发生NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl、2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,无元素的化合价变化,为非氧化还原反应,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及元素的化合价变化为解答关键,侧重分析与应用能力的考查,注意元素化合价的应用,题目难度不大.

练习册系列答案
相关题目
7.对于反应:N2+3H2?2NH3△H<0,下列叙述正确的是( )
| A. | 升高温度,逆反应速率加快,正反应速率减慢 | |
| B. | 使用催化剂比不使用催化剂化学平衡常数要大 | |
| C. | 由勒夏特列原理可知合成氨时,分离出NH3可以提高原料利用率 | |
| D. | 加压能加快反应速率,因为增加了活化分子百分数 |
8.下列说法中正确的是( )
| A. | Na2S2O3 (aq)+2HCl(aq)=2NaCl(aq)+S(s)+SO2(g)+H2O(l)在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反 应方向移动 | |
| B. | 若在恒容容器中发生反应:N2(g)+3H2(g)?2NH3 (g),达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率一时间图象可用图一表示 | |
| D. | 若在恒压容器中发生反应:2SO3 (g)?2SO2 (g)+O2 (g),达到平衡后再充人适量He,其速率一时间图象可用图二表示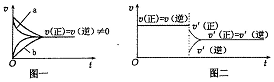 |
9.Na3N是一种离子化合物,它与水反应有NH3生成,以下关于Na3N的叙述正确的是( )
| A. | Na+与N3-的电子层结构都与氩原子相同 | |
| B. | Na3N中的Na+的半径大于N3-的半径 | |
| C. | Na3N与盐酸反应可生成两种盐 | |
| D. | Na3N与水的反应属于氧化还原反应 |
16.下列离子方程式的书写正确的是( )
| A. | 铁跟稀盐酸反应2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸氢钙溶液中加入盐酸Ca(HCO3)2+2HCl═CaCl2+H2O+CO2↑ | |
| C. | CO2通入足量石灰水中CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | NaHCO3溶液中加入盐酸HCO3-+H+═H2CO3 |
6.下列有关离子反应的判断正确的是( )
| A. | 用NaOH溶液吸收尾气中的氯气:Cl2+4OH-═2ClO-+2H2O | |
| B. | SO2饱和溶液中NH4+、K+、CO32-、SO32-可大量存在 | |
| C. | 2Fe3++Fe═3Fe2+成立,说明氧化性:Fe3+>Fe2+ | |
| D. | 向NaHS溶液中加入适量硝酸发生反应:HS-+H+═H2S↑ |
13.NaNO2+NH4Cl═NaCl+N2+2H2O.下列关于该反应的说法中,正确的是( )
| A. | NH4Cl中的N元素被还原 | |
| B. | 生成1 mol N2时转移的电子数为6 mol | |
| C. | NaNO2是氧化剂 | |
| D. | N2既是氧化剂又是还原剂 |
10.密度为1.45g/cm3的硫酸溶液中,逐滴加入BaCl2溶液,直至沉淀完全为止,过滤,已知滤液与原BaCl2溶液的质量相等,则原硫酸溶液的物质的量浓度为( )
| A. | 3.2mol/L | B. | 6.2mol/L | C. | 14.8mol/L | D. | 18.4mol/L |
 ;
;