题目内容
9.Na3N是一种离子化合物,它与水反应有NH3生成,以下关于Na3N的叙述正确的是( )| A. | Na+与N3-的电子层结构都与氩原子相同 | |
| B. | Na3N中的Na+的半径大于N3-的半径 | |
| C. | Na3N与盐酸反应可生成两种盐 | |
| D. | Na3N与水的反应属于氧化还原反应 |
分析 A.Na+和N3-离子核外电子数相同,都是10电子;
B.电子数相同的微粒,原子序数越大半径越小;
C.Na3N与足量盐酸作用,根据与水的反应生成氨气,可知生成氯化钠和氯化铵两种盐;
D.Na3N与水的反应为:Na3N+H2O=NaOH+NH3↑.
解答 解:A.Na+和N3-离子核外电子数相同,都是10电子,则电子层结构都与氖原子相同,故A错误;
B.电子数相同的微粒,原子序数越大半径越小,则Na+的半径小于N3-的半径,故B错误;
C.Na3N与盐酸反应Na3N+4HCl=3NaCl+NH4Cl,生成氯化钠和氯化铵两种盐,故C正确;
D.Na3N与水的反应中各元素化合价不变,不属于氧化还原反应,故D错误;
故选:C.
点评 本题考查了原子结构、离子半径大小的比较、氧化还原反应的判断等知识点,明确微粒的结构与水反应的原理是解题关键,难度不大,注意基础知识的总结.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
15.氯苯是燃料、医药、有机合成的中间体,是重要的有机化工产品.实验室制取氯苯如图1所示(加热和固定仪器的装置略去).
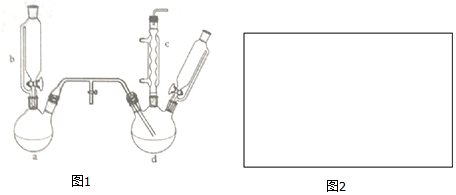
回答下列问题:
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a装置中的固体反应物可以是BC.(填序号)
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d装置有FeCl3和苯),加热维持反应温度40-60℃,温度过高会生成过多的二氯苯.对d加热的方法是水浴加热.
(3)装置c的名称是(球形)冷凝管,装置c出口的气体成分有HCl、Cl2、水蒸气和苯蒸汽.
(4)制取氯苯的化学方程式为: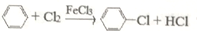 .
.
(5)装置d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.
①碱洗之前要水洗.其目的是洗去FeCl3、HCl等无机物.节省碱的用量,降低成本.
②10%NaOH溶液碱洗时发生氧化还原反应的化学反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O.
(6)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸汽,请在图2中画出,并标明所用试剂.
(7)工业生产中苯的流失情况如表所示:
则10t 苯可制得成品氯苯$\frac{10×(1-0.0892)×112.5}{78}$t.(列出计算式即可.氯苯和苯的相对分子质量分别是112,5和78)

回答下列问题:
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a装置中的固体反应物可以是BC.(填序号)
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d装置有FeCl3和苯),加热维持反应温度40-60℃,温度过高会生成过多的二氯苯.对d加热的方法是水浴加热.
(3)装置c的名称是(球形)冷凝管,装置c出口的气体成分有HCl、Cl2、水蒸气和苯蒸汽.
(4)制取氯苯的化学方程式为:
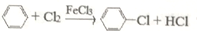 .
.(5)装置d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.
①碱洗之前要水洗.其目的是洗去FeCl3、HCl等无机物.节省碱的用量,降低成本.
②10%NaOH溶液碱洗时发生氧化还原反应的化学反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O.
(6)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸汽,请在图2中画出,并标明所用试剂.
(7)工业生产中苯的流失情况如表所示:
| 项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
| 苯流失量(t/kg) | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
16.下列仪器名称为“蒸馏烧瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |
4.下列关于气体摩尔体积的叙述中正确的是( )
| A. | 1mol二氧化碳在标准状况时所占的体积约是22.4L | |
| B. | 氧气在标准状况下頕有体积约为22.4L | |
| C. | 1mol任何物质在0℃,1.01×105Pa时体积都约是22.4L | |
| D. | 1mol任何气体的体积都约是22.4L |
14.下列各组物质中能用淀粉碘化钾试纸鉴别的是( )
| A. | 溴水和碘水 | B. | 盐酸和稀硫酸 | C. | 溴水和稀盐酸 | D. | 氯化钾和碘水 |
1.下列化工生产过程中,未涉及氧化还原反应的是( )
| A. | 海带提碘 | B. | 氯碱工业 | C. | 海水提溴 | D. | 侯德榜制碱法 |
18.下列关于氯气及其组成的说法正确的是( )
| A. | 氯气有毒,不能吸入不能闻 | B. | 氯元素呈黄绿色 | ||
| C. | 氯离子、氯原子都是氯元素 | D. | 氯气有漂白性 |
19.下列说法正确的是( )
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 植物油的主要成分是高级脂肪酸 | |
| C. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| D. | 食用白糖的主要成分是蔗糖 |