题目内容
Hagemann 酶(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反映条件略去):
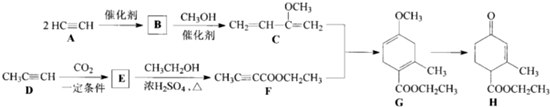
(1)(A→B)为加成反应,则B的结构简式是 ;B→C的反应类型是 .
(2)H中含有的官能团名称是 ,F的名称(系统命名)是 .
(3)E→F的化学方程式是 .
(4)TMOB是H的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有一个吸收峰;②存在甲氧基(CH3O-).TMOB的结构简式是 .
(5)下列说法正确的是 .
a.A能和HCl反应得到聚氯乙烯的单体 b.D和F中均含有2个π健
c.1mol G完全燃烧生成7mol H2O d.H能发生加成,取代反应.

(1)(A→B)为加成反应,则B的结构简式是
(2)H中含有的官能团名称是
(3)E→F的化学方程式是
(4)TMOB是H的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有一个吸收峰;②存在甲氧基(CH3O-).TMOB的结构简式是
(5)下列说法正确的是
a.A能和HCl反应得到聚氯乙烯的单体 b.D和F中均含有2个π健
c.1mol G完全燃烧生成7mol H2O d.H能发生加成,取代反应.
考点:真题集萃,有机物的合成
专题:有机物的化学性质及推断
分析:从流程图可以看出,A→B是两个乙炔的加成反应,生成B,然后再甲醇(CH3OH)发生加成反应生成C( ),可知B的结构简式是CH2=CH-C≡CH;结合F(CH3C≡CCOOCH2CH3)是由E和CH3CH2OH发生酯化反应的到的,所以E的结构简式为CH3C≡CCOOH.
),可知B的结构简式是CH2=CH-C≡CH;结合F(CH3C≡CCOOCH2CH3)是由E和CH3CH2OH发生酯化反应的到的,所以E的结构简式为CH3C≡CCOOH.
(1)A→B是两个乙炔的加成反应,所以B的结构简式为CH2=CH-C≡CH,B→C是CH2=CH-C≡CH和甲醇的加成反应;
(2)H含有的官能团是碳碳双键,羰基,酯基;F命名为2-丁炔酸乙酯;
(3)E→F的反应是E(CH3C≡CCOOH)和CH3CH2OH发生的酯化反应;
(4)TMOB结构中含有苯环,存在甲氧基(CH3O-),又因为除苯环吸收峰外仅有1个吸收峰,所以应该含有3个甲氧基(CH3O-),且三个甲氧基等价;
(5)a、乙炔与HCl加成可生成氯乙烯;
b、D中碳碳三键中含有2个π键,F中碳碳三键中含有2个π键、碳氧双键中含有1个π键;
c、一个G分子含有16个H原子,根据H原子守恒计算;
d、羰基可加成,酯基可发生水解反应,属于取代反应;
 ),可知B的结构简式是CH2=CH-C≡CH;结合F(CH3C≡CCOOCH2CH3)是由E和CH3CH2OH发生酯化反应的到的,所以E的结构简式为CH3C≡CCOOH.
),可知B的结构简式是CH2=CH-C≡CH;结合F(CH3C≡CCOOCH2CH3)是由E和CH3CH2OH发生酯化反应的到的,所以E的结构简式为CH3C≡CCOOH.(1)A→B是两个乙炔的加成反应,所以B的结构简式为CH2=CH-C≡CH,B→C是CH2=CH-C≡CH和甲醇的加成反应;
(2)H含有的官能团是碳碳双键,羰基,酯基;F命名为2-丁炔酸乙酯;
(3)E→F的反应是E(CH3C≡CCOOH)和CH3CH2OH发生的酯化反应;
(4)TMOB结构中含有苯环,存在甲氧基(CH3O-),又因为除苯环吸收峰外仅有1个吸收峰,所以应该含有3个甲氧基(CH3O-),且三个甲氧基等价;
(5)a、乙炔与HCl加成可生成氯乙烯;
b、D中碳碳三键中含有2个π键,F中碳碳三键中含有2个π键、碳氧双键中含有1个π键;
c、一个G分子含有16个H原子,根据H原子守恒计算;
d、羰基可加成,酯基可发生水解反应,属于取代反应;
解答:
解:(1)A→B是两个乙炔的加成反应,所以B的结构简式为CH2=CH-C≡CH,B→C是CH2=CH-C≡CH和甲醇的加成反应生成C( ),
),
故答案为:CH2=CH-C≡CH;加成反应;
(2)根据H的结构简式可知,H含有的官能团是碳碳双键,羰基,酯基;F的结构简式为CH3C≡CCOOCH2CH3,命名为2-丁炔酸乙酯,
故答案为:碳碳双键,羰基,酯基;2-丁炔酸乙酯;
(3)E→F的反应是E(CH3C≡CCOOH)和CH3CH2OH发生的酯化反应,所以反应方程式为CH3C≡CCOOH+CH3CH2OH
CH3C≡CCOOCH2CH3+H2O,
故答案为:CH3C≡CCOOH+CH3CH2OH
CH3C≡CCOOCH2CH3+H2O;
(4)TMOB是H的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O-),说明TMOB结构中含有苯环,存在甲氧基(CH3O-),又因为除苯环吸收峰外仅有1个吸收峰,所以应该含有3个甲氧基(CH3O-),且三个甲氧基等价,所以TMOB的结构简式 ,
,
故答案为: ;
;
(5)a、乙炔与HCl加成可生成氯乙烯,氯乙烯是生产聚氯乙烯的单体,故a正确;
b、D中碳碳三键中含有2个π键,F中碳碳三键中含有2个π键、碳氧双键中含有1个π键,共3个π键,故b错误;
c、一个G分子含有16个H原子,1molG含有16molH,1mol G完全燃烧生成8molH2O,故c错误;
d、H中的羰基可加成,酯基可发生水解反应,水解反应属于取代反应,故d正确;
故答案为:a、d.
 ),
),故答案为:CH2=CH-C≡CH;加成反应;
(2)根据H的结构简式可知,H含有的官能团是碳碳双键,羰基,酯基;F的结构简式为CH3C≡CCOOCH2CH3,命名为2-丁炔酸乙酯,
故答案为:碳碳双键,羰基,酯基;2-丁炔酸乙酯;
(3)E→F的反应是E(CH3C≡CCOOH)和CH3CH2OH发生的酯化反应,所以反应方程式为CH3C≡CCOOH+CH3CH2OH
| 浓硫酸 |
| △ |
故答案为:CH3C≡CCOOH+CH3CH2OH
| 浓硫酸 |
| △ |
(4)TMOB是H的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O-),说明TMOB结构中含有苯环,存在甲氧基(CH3O-),又因为除苯环吸收峰外仅有1个吸收峰,所以应该含有3个甲氧基(CH3O-),且三个甲氧基等价,所以TMOB的结构简式
 ,
,故答案为:
 ;
;(5)a、乙炔与HCl加成可生成氯乙烯,氯乙烯是生产聚氯乙烯的单体,故a正确;
b、D中碳碳三键中含有2个π键,F中碳碳三键中含有2个π键、碳氧双键中含有1个π键,共3个π键,故b错误;
c、一个G分子含有16个H原子,1molG含有16molH,1mol G完全燃烧生成8molH2O,故c错误;
d、H中的羰基可加成,酯基可发生水解反应,水解反应属于取代反应,故d正确;
故答案为:a、d.
点评:本题考查了有机物的合成,难度中等,为历年高考选作试题,试题综合性强,把握有机物合成中官能团的变化是解题的关键.

练习册系列答案
相关题目
下列说法正确的是( )
| A、钙和氮均为人体所需的微量元素 |
| B、二氧化硅是太阳能电池的主要材料 |
| C、油脂和蛋白质均属于高分子化合物 |
| D、明矾与水作用能生成有吸附性的物质 |
下列涉及有机物的说法正确的是( )
| A、甲酸的性质与乙酸类似,都不能被酸性高锰酸钾溶液氧化 |
| B、石油和植物油都是混合物,且属于不同类的有机物 |
| C、乙醇转化为乙醛的反应有碳氧双键生成,属于消去反应 |
| D、纤维素、蔗糖、葡萄糖和淀粉酶在一定条件下都可发生水解反应 |
室温下,下列溶液中粒子浓度关系正确的是( )
| A、Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| B、Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
| C、Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| D、CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表: