题目内容
室温下,下列溶液中粒子浓度关系正确的是( )
| A、Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| B、Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
| C、Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| D、CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
考点:真题集萃,离子浓度大小的比较
专题:盐类的水解专题
分析:A.硫离子水解显碱性,存在两步水解,以第一步为主;
B.溶液中存在电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),物料守恒为c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-);
C.溶液中存在电荷守恒;
D.由物料守恒可知,c(Na+)=c(CH3COO-)+c(CH3COOH),2c(Ca2+)=c(Cl-).
B.溶液中存在电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),物料守恒为c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-);
C.溶液中存在电荷守恒;
D.由物料守恒可知,c(Na+)=c(CH3COO-)+c(CH3COOH),2c(Ca2+)=c(Cl-).
解答:
解:A.硫离子水解显碱性,存在两步水解,两步水解均产生OH-,则c(OH-)>c(HS-),以第一步为主,则浓度关系为c(Na+)>c(OH-)>c(HS-)>c(H2S),故A错误;
B.溶液中存在电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),物料守恒为c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-),由两守恒式可知,存在质子守恒式为c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故B正确;
C.溶液中存在电荷守恒,则c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),故C错误;
D.由物料守恒可知,c(Na+)=c(CH3COO-)+c(CH3COOH),2c(Ca2+)=c(Cl-),则c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-),故D错误;
故选B.
B.溶液中存在电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),物料守恒为c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-),由两守恒式可知,存在质子守恒式为c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故B正确;
C.溶液中存在电荷守恒,则c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),故C错误;
D.由物料守恒可知,c(Na+)=c(CH3COO-)+c(CH3COOH),2c(Ca2+)=c(Cl-),则c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-),故D错误;
故选B.
点评:本题为2014年安徽高考化学试题,测定离子浓度大小的比较,把握盐类水解及电荷守恒、物料守恒为解答的关键,侧重分析能力及知识综合应用能力的考查,题目难度不大.

练习册系列答案
相关题目
某致基因突变物质的结构简式如图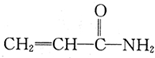 .下列相关分析正确的是( )
.下列相关分析正确的是( )
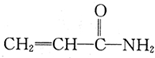 .下列相关分析正确的是( )
.下列相关分析正确的是( )| A、电负性:C<N<O |
| B、该分子中σ键与π键数目之比为4:2 |
| C、该分子所有原子处于同一平面 |
D、该分子的加聚产物为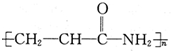 |
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族,下列说法正确的是( )
| A、原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B、Y分别与Z、W形成的化合物中化学键类型相同 |
| C、X的最高氧化物对应的水化物的酸性比W的弱 |
| D、Y的气态简单氢化物的热稳定性比W的强 |
某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4(无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是( )
| A、一定没有CO2,肯定有H2 |
| B、一定有CO、CO2和水蒸气? |
| C、一定有H2、CO2和HCl |
| D、可能有CO2、NH3和水蒸气? |
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A、氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 |
| B、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C、向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
| D、向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
下列实验能达到目的是( )
| A、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B、将NH4Cl溶液蒸干制备NH4Cl固体 |
| C、用萃取分液的方法除去酒精中的水 |
| D、用可见光束照射以区别溶液和胶体 |