题目内容
在一定条件下,在容积为2L的密闭容器中,将2mol 气体M和3mol N气体混合,发生如下反应:2M(g)+3N(g)?x Q(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4mol/L,下列有关叙述正确的是( )
| A、x值为2 |
| B、混合气体的密度增大 |
| C、平衡时N的浓度为0.3 mol/L |
| D、N的转化率为20% |
考点:化学平衡的计算
专题:化学平衡专题
分析:A.根据n=cV计算生成Q的物质的量,结合R的物质的量,利用物质的量之比等于化学计量数之比计算x的值;
B.容器的容积不变,混合气体的质量不变,根据ρ=
判断;
C.根据生成的R的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的N的物质的量,N的平衡浓度=
;
D.根据C可知参加反应N的物质的量,N的转化率=
×100%.
B.容器的容积不变,混合气体的质量不变,根据ρ=
| m |
| V |
C.根据生成的R的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的N的物质的量,N的平衡浓度=
| 平衡N的物质的量 |
| V |
D.根据C可知参加反应N的物质的量,N的转化率=
| 参加反应N的物质的量 |
| N的起始量 |
解答:
解:A.平衡时生成的Q的物质的量为0.4mol/L×2L=0.8mol,生成R为2.4mol,物质的量之比等于化学计量数之比,故0.8mol:2.4mol=x:3,解得x=1,故A错误;
B.反应体系中各组分都是气体,混合气体的质量不变,容器的容积恒定,根据ρ=
可知混合气体的密度不变,故B错误;
C.反应达到平衡时,生成2.4molR,由方程式可知,参加反应的N的物质的量为2.4mol,故平衡时N的物质的量为3mol-2.4mol=0.6mol,N的平衡浓度为
=0.3mol/L,故C正确;
D.参加反应的N的物质的量为2.4mol,则N的转化率为
×100%=80%,故D错误,
故选:C.
B.反应体系中各组分都是气体,混合气体的质量不变,容器的容积恒定,根据ρ=
| m |
| V |
C.反应达到平衡时,生成2.4molR,由方程式可知,参加反应的N的物质的量为2.4mol,故平衡时N的物质的量为3mol-2.4mol=0.6mol,N的平衡浓度为
| 0.6mol |
| 2L |
D.参加反应的N的物质的量为2.4mol,则N的转化率为
| 2.4mol |
| 3mol |
故选:C.
点评:本题考查化学平衡的有关计算,难度不大,侧重学生对基础知识的巩固.

练习册系列答案
相关题目
在盛有AgCl沉淀的试管中加入KI溶液,振荡后可观察到白色沉淀逐渐转变为黄色沉淀.由这个实验可以说明( )
| A、I-的还原性比Cl-的强 |
| B、Cl-的半径比I-的小 |
| C、AgI的溶解度比AgCl的大 |
| D、实验过程中,平衡AgCl(s)?Ag+(aq)+Cl-(aq)不断向右移动 |
一个原电池反应为:Zn+Cu2+═Zn2++Cu,该原电池的电极及电解质溶液可能是( )
| 正极 | 负极 | 电解质溶液 | |
| A | Zn | Cu | ZnCl2溶液 |
| B | Cu | Zn | 稀H2SO4 |
| C | Cu | Zn | CuSO4溶液 |
| D | 石墨 | Zn | CuSO4溶液 |
| A、A | B、B | C、C | D、D |
家用消毒液发生器是化学知识在日常生活中的“创新”应用.该发生器利用常见的精盐和自来水为反应物.通电时,发生器内电解槽里的极板上产生大量水泡.切断电源后所得的消毒液有强烈的杀菌能力,且对人体无害.溶液中发生的主要的反应为:2NaCl+2H2O
2NaOH+H2+Cl2 2NaOH+Cl2=NaCl+NaClO+H2O则所得消毒液的有效成分是( )
| ||
| A、NaCl |
| B、Cl2 |
| C、NaClO |
| D、HClO |
已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12.在只含有KCl、K2CrO4的混合溶液中滴加0.001000mol/L的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO42-的浓度是5.000×l0-3 mol/L,此时溶液中Cl-的物质的量浓度是( )
| A、8.90×10-6mol/L |
| B、1.36×10-5mol/L |
| C、1×10-5mol/L |
| D、4.45×10-2mol/L |
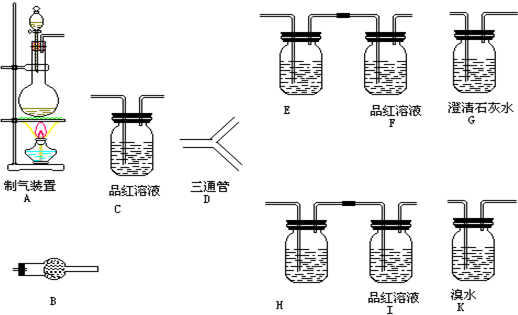
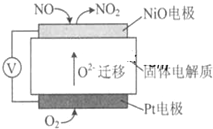 SO2、NOx是大气的主要污染物.
SO2、NOx是大气的主要污染物.