题目内容
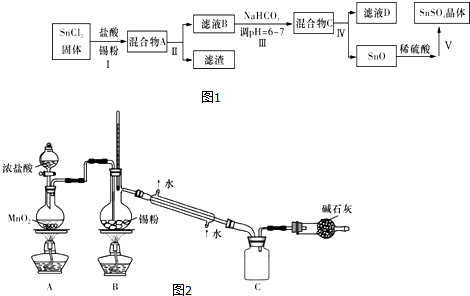
4.“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义.请回答下列问题:SiO2$→_{高温}^{ⅠC}$Si(粗)$→_{300℃}^{Ⅱ.HCl}$SiHCl3$→_{1000-1100℃}^{Ⅲ.过量H_{2}}$Si(纯)
(1)无机非金属材料.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.这种材料可以按下列方法制备:
①写出步骤I的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
②步骤II经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的实验方法是蒸馏或分馏,所用到的玻璃仪器除酒精灯、温度计、锥形瓶外还需要蒸馏烧瓶和冷凝管.
(2)磁性材料.这种黑色材料含有某种铁的氧化物,请写出该氧化物溶于稀硫酸溶液的化学方程式Fe3O4+4H2SO4═FeSO4+Fe2(SO4)3+4H2O,简述检验所得溶液中较高价态阳离子的实验操作方法取少量该溶液于试管中,滴入几滴KSCN溶液,溶液变为红色,说明溶液中含有Fe3+.
(3)激光材料.我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料.请用离子方程式来证明它是一种两性氧化物:Al2O3+6H+═2Al3++3H2O、Al2O3+2OH-═2AlO2-+H2O.
(4)高分子材料.一种新型高效净水剂[Al Fe(OH)nCl6-n]m属于无机高分子材料,它广泛应用于生活用水和工业污水的处理,其中铁元素的化合价为+3.
(5)合金材料.取等质量的两份某镁铝合金分别加入足量的稀盐酸和氢氧化钠溶液中,产生的H2体积分别为100ml,90ml则该合金中镁,铝的质量之比为4:27.
(6)消毒材料.棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,补充完整并配平下列反应方程式:2Cl2+2Na2CO3+H2O═2NaHCO3+2NaCl+1 Cl2O.
分析 (1)①焦炭在高温下可以置换二氧化硅中的硅;
②根据熔沸点的不同实现物质分离的方法为蒸馏或分馏;所用到的玻璃仪器除酒精灯、温度计、锥形瓶外还需要蒸馏烧瓶和冷凝管;
(2)具有磁性的黑色材料含有某种铁的氧化物即Fe3O4,与稀硫酸溶液反应生成硫酸铁、硫酸亚铁和水;根据KSCN溶液与三价铁离子显血红色检验;
(3)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,均放出氢气;
(4)根据AlFe(OH)nCl6-n中各元素的化合价代数和为0计算;
(5)因为铝与氢氧化钠溶液反应生成氢气,而镁不反应,所以90ml氢气为铝与氢氧化钠溶液反应生成,又铝和镁都能与盐酸反应生成氢气,所以100ml氢气为铝和镁与盐酸反应生成,据此计算;
(6)反应中氯气是自身氧化还原反应,化合价从0价变化为-1价和+1价,依据原子守恒和得失电子守恒解答.
解答 解:(1)①工业上用焦炭在高温下置换二氧化硅中的硅来制备粗硅,方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
②SiHCl3(沸点33.0℃)、SiCl4(沸点57.6℃)、HCl(沸点-84.7℃),他们的沸点不同,根据沸点的不同实现物质分离的方法为蒸馏或分馏,所用到的玻璃仪器除酒精灯、温度计、锥形瓶外还需要蒸馏烧瓶和冷凝管;故答案为:蒸馏或分馏;蒸馏烧瓶和冷凝管;
(2)具有磁性的黑色材料含有某种铁的氧化物即Fe3O4,与稀硫酸溶液反应生成硫酸铁、硫酸亚铁和水,方程式为:Fe3O4+4H2SO4═FeSO4+Fe2(SO4)3+4H2O;因为三价铁离子遇KSCN溶液显血红色,所以检验三价铁离子的实验操作方法是取少量该溶液于试管中,滴入几滴KSCN溶液,溶液变为红色,说明溶液中含有Fe3+;
故答案为:Fe3O4+4H2SO4═FeSO4+Fe2(SO4)3+4H2O;取少量该溶液于试管中,滴入几滴KSCN溶液,溶液变为红色,说明溶液中含有Fe3+;
(3)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,离子方程式分别为:Al2O3+6H+═2Al3++3H2O、Al2O3+2OH-═2AlO2-+H2O;
故答案为:Al2O3+6H+═2Al3++3H2O、Al2O3+2OH-═2AlO2-+H2O;
(4)化合物中铝元素显+3价,氢氧根为-1价,氯元素为-1价,各元素的化合价代数和为0,故铁元素的化合价为+3价,故答案为:+3;
(5)因为铝与氢氧化钠溶液反应生成氢气,而镁不反应,所以90ml氢气为铝与氢氧化钠溶液反应生成,又铝和镁都能与盐酸反应生成氢气,所以100ml氢气为铝和镁与盐酸反应生成,根据得失电子守恒,则铝生成90ml氢气,镁生成100-90=10ml氢气,所以合金中镁,铝的质量之比为10×24:90×$\frac{2}{3}$×27=4:27,故答案为:4:27;
(6)反应中氯气是自身氧化还原反应,化合价从0价变化为-1价和+1价,依据原子守恒进而电子守恒得到,反应物缺项为H2O,配平的化学方程式为:2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O,
故答案为:2;2;H2O;2;2;1.
点评 本题考查了有关硅的无机推断、实验方案设计的有关知识,考查的知识点范围较广,题目难度中等,掌握实验原理的解题的关键,注意常用化学用语的书写.

| A. | 硫元素的质量比为5:4 | B. | 任何情况下体积比均为1:1 | ||
| C. | 含有的O2、O3两分子数之比为1:1 | D. | SO2、SO3两分子数之比为1:1 |
| A. | 干燥的 | B. | 不漏水的 | ||
| C. | 用欲配制的溶液润洗过的 | D. | 标有刻度的 |
 在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的$\frac{1}{4}$,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的$\frac{1}{4}$,F元素位于周期表的ds区,其基态原子最外能层只有一个电子. .
.