题目内容
7.不能用来鉴别Na2CO3与NaHCO3两种白色固体的实验操作是( )| A. | 分别加热,观察有无气体生成 | |
| B. | 制成稀溶液,再分别滴加同浓度的稀盐酸 | |
| C. | 制成稀溶液,分别加入CaCl2溶液 | |
| D. | 制成溶液,分别加入少量澄清的石灰水 |
分析 Na2CO3和NaHCO3性质不同:①NaHCO3受热分解,②碳酸钙难溶于水,而碳酸氢钙溶于水,③NaHCO3与盐酸反应剧烈,④都能澄清石灰水反应生成碳酸钙沉淀.
解答 解:A.Na2CO3受热不分解,而NaHCO3受热分解,可以鉴别,故A不选;
B.向Na2CO3中逐滴加入盐酸时,先无气体产生,当盐酸加入较多时,可产生气体,而向NaHCO3中加入同浓度盐酸,则迅速产生气体,可以通过产生气体的快慢加以鉴别,故B不选;
C.Na2CO3与CaCl2溶液作用产生CaCO3沉淀,而NaHCO3则不与CaCl2溶液反应,无沉淀产生,也可以鉴别,故C不选;
D.Na2CO3和NaHCO3均可与澄清石灰水反应产生白色沉淀,现象相同,无法鉴别,故D选.
故选D.
点评 本题考查物质的鉴别,题目难度不大,注意碳酸钠和碳酸氢钠的性质的异同,学习中注重相关基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | lmol•L?1的NaCl溶液中所含Na+为NA个 | |
| B. | 标准状况下,11.2 L SO3所含的分子数为0.5NA | |
| C. | 0.1 mol CH4所含的电子数为1NA | |
| D. | 2molNO和1mol O2混合,所得气体分子数为2NA |
18.下列物质中,不能电离出酸根离子的是( )
| A. | Na2CO3 | B. | KMnO4 | C. | KOH | D. | H2SO4 |
15.下列选项中,对于指定项目的数目前后相等的是( )
| A. | 电子数:17gOH-与1mol-OH | |
| B. | 双键数目:1mol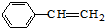 与4mol C2H4 与4mol C2H4 | |
| C. | 分子数:常温常压下16g氧气与4g氦气 | |
| D. | 阴离子总数:72gCaO2与62g Na2O |
12. X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | Z的单质与氢气反应较Y剧烈 | |
| B. | X、Y形成的化合物都易溶于水 | |
| C. | 只由这四种元素不能组成有机化合物 | |
| D. | 最高价氧化物对应水化物的酸性W比Z弱 |
19. 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | lmol该有机物最多能与2molH2发生加成反应 | |
| B. | 该有机物的分子式为C7H8O3 | |
| C. | 该有机物能发生取代反应、加成反应、消去反应和氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
16.单质铜及其化合物一般都具有特殊的颜色,如
某学校学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O,进行了认真的研究.
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物; ②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+═Cu+Cu2++H2O.
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化.
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色.
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g.
(1)写出Cu2O与稀硝酸反应的化学方程式:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O.
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:不合理,因为铜和氧化亚铜均可溶于稀硝酸形成蓝色溶液.
方案2:合理,因为氧化亚铜与稀硫酸生成Cu和Cu2+,导致溶液呈蓝色.
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为c<$\frac{9b-a}{8}$,在该实验方案中最少应进行4次称量.
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示.

(4)该探究方案中检验气体发生装置气密性的方法为:关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置漏气;(说明操作方法、现象和结论).
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有ABC(填序号).
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管.
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4•5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |
Ⅰ.查阅资料得出下列信息:
①Cu2O属于碱性氧化物; ②高温灼烧CuO生成Cu2O;
③Cu2O在酸性条件下能发生反应:Cu2O+2H+═Cu+Cu2++H2O.
Ⅱ.设计实验方案:
方案1:取该红色固体溶于足量的稀硝酸中,观察溶液颜色变化.
方案2:取该红色固体溶于足量的稀硫酸中,观察溶液是否呈蓝色.
方案3:称得干燥坩埚的质量为a g,取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g.
(1)写出Cu2O与稀硝酸反应的化学方程式:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O.
(2)请你评价方案1和方案2的合理性,并简述理由:
方案1:不合理,因为铜和氧化亚铜均可溶于稀硝酸形成蓝色溶液.
方案2:合理,因为氧化亚铜与稀硫酸生成Cu和Cu2+,导致溶液呈蓝色.
(3)方案3中,若确认红色固体中含有Cu2O,则a、b、c的关系为c<$\frac{9b-a}{8}$,在该实验方案中最少应进行4次称量.
Ⅲ.学习小组乙设计了新的探究方案,拟根据干燥管中无水硫酸铜是否变蓝判断红色固体中是否含有Cu2O,装置如图所示.

(4)该探究方案中检验气体发生装置气密性的方法为:关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置漏气;(说明操作方法、现象和结论).
(5)为确保探究的科学、合理和安全,你认为实验中还应采取的措施有ABC(填序号).
A.在氢气发生装置与硬质玻璃管之间增加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有无水硫酸铜的干燥管后再连接一个装有碱石灰的干燥管.
17.某有机物的结构简式为HO-CH2CH=CHCH2-COOH.下列说法不正确的是( )
| A. | 它能与Na、NaOH、NaHC03等物质反应 | B. | 它能发生酯化、氧化、加成等反应 | ||
| C. | 该有机物分子式为C5H8O3 | D. | 它是乙酸也是乙醇的同系物 |