题目内容
10.下列离子或分子组中,在相应的环境中一定能大量共存的是( )| 选项 | 环境要求 | 离子或分子 |
| A | Al2(SO4)3溶液中 | K+,AlO${\;}_{2}^{-}$,Cl-,NO${\;}_{3}^{-}$ |
| B | 滴加石蕊试液显蓝色的溶液中 | Na+,K-,SO${\;}_{3}^{2-}$,S2- |
| C | 水电离产生的c(OH-)=10-12mol•L-1的溶液 | ClO-,CO${\;}_{3}^{2-}$,NH${\;}_{4}^{+}$,K- |
| D | 氯气中 | O2,NH3,CO2,HCl |
| A. | A | B. | B | C. | C | D. | D |
分析 A.离子之间相互促进水解;
B.滴加石蕊试液显蓝色的溶液,显碱性;
C.水电离产生的c(OH-)=10-12mol•L-1的溶液,为酸或碱溶液;
D.氯气具有氧化性.
解答 解:A.AlO2-、Al3+相互促进水解,不能共存,故A不选;
B.滴加石蕊试液显蓝色的溶液,显碱性,该组离子之间不反应,可大量共存,故B选;
C.水电离产生的c(OH-)=10-12mol•L-1的溶液,为酸或碱溶液,酸溶液中不能大量存在ClO-、CO32-,故C不选;
D.氯气具有氧化性,与NH3发生氧化还原反应不能共存,且NH3与HCl反应不能共存,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
20.下列有关碳及其化合物的化学用语正确的是( )
| A. | 乙炔的结构式为CH≡CH | B. | 甲烷分子的比例模型为 | ||
| C. | 碳原子的结构示意图为  | D. | 碳原子最外层电子的轨道表示式为 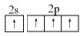 |
1.下列微粒半径由大到小的排列是( )
| A. | Ca,Mg,Na | B. | Cl-,S2-,O2- | C. | P3-,S2-,Cl- | D. | K+、Cl-,S2- |
15.按如图所示装置进行下列不同的操作,其中不正确的是( )
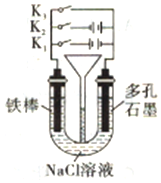

| A. | 铁腐蚀的速度由大到小的顺序:只闭合K3>只闭合K1>都断开>只闭合K2 | |
| B. | 只闭合K3,正极的电极反应式:2H2O+O2+4e-=4OH- | |
| C. | 先只闭合K1,一段时间后,漏斗内液曲上升,然后再只闭合K2,漏斗内液面上升 | |
| D. | 只闭合K2,U型管左、右两端液面均下降 |
2.下列有关叙述或化学用语表示正确的是( )
| A. | S2-的结构示意图: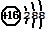 | |
| B. | 过氧化氢的电子式: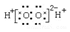 | |
| C. | Ge原子的简化电子排布式:[Ar]4s24p2 | |
| D. | 氯化钠的分子式:NaCl |
19.海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:

注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变.
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp=4.68×10-6;Ksp=5.61×10-12.请回答下列问题:
(6)沉淀物X为CaCO3;
(7)滤液N中Ca2+浓度为0.01mol/L;
(8)加NaOH固体调整pH=12.5是否可行否(填“是”“否”);原因是如果pH调制12.5会使氢氧化钙沉淀,会使产品不纯.

| 模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp=4.68×10-6;Ksp=5.61×10-12.请回答下列问题:
(6)沉淀物X为CaCO3;
(7)滤液N中Ca2+浓度为0.01mol/L;
(8)加NaOH固体调整pH=12.5是否可行否(填“是”“否”);原因是如果pH调制12.5会使氢氧化钙沉淀,会使产品不纯.
20.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.下列说法不正确的是( )
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>Fe3+>稀硫酸 | |
| C. | 向偏铝酸钠溶液通入少量的二氧化碳,生成白色沉淀和碳酸钠,说明HCO3-和AlO2-不能共存 | |
| D. | 在铝制容器中加入食盐溶液,再将变量的银器浸入该溶液中,一段时间后发现黑色会褪去,是因为银器表面Ag2S和金属铝构成原电池而发生了反应 |
