题目内容
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H(图1中表示生成1mol物质时的能量)
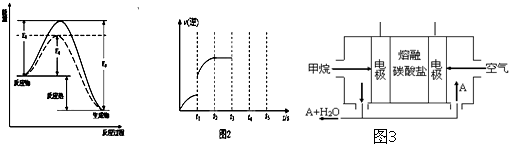
(1)根据图1请写出合成甲醇的热化学方程式 (热量用E1、E2或E3表示).
(2)该反应的逆反应速率随时间变化的关系如图2.t1时改变了某种条件,改变的条件可能是升高了温度、 、 (填写2项).
(3)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.2v(H2)(逆)=v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 .若此时再向该容器中投入a mol CO、2a mol H2和a mol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”)与原平衡相比,CO的物质的量浓度 (填增大、不变或减小).
(5)某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见图3).A物质的化学式是 ;该原电池的负极反应式可表示为 .

(1)根据图1请写出合成甲醇的热化学方程式
(2)该反应的逆反应速率随时间变化的关系如图2.t1时改变了某种条件,改变的条件可能是升高了温度、
(3)判断反应达到平衡状态的依据是(填字母序号,下同)
A.2v(H2)(逆)=v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为
(5)某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见图3).A物质的化学式是
考点:化学平衡状态的判断,热化学方程式,化学电源新型电池,化学反应速率的影响因素,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)图象分析反应是放热反应,反应的焓变=断裂化学键吸收的能量-形成化学键放出的热量,标注物质的聚集状态和对应反应的焓变写出;
(2)图象分析可知是逆反应速率增大,反应是否达到平衡不知,所以增大逆反应速率的因素均符合;
(3)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(4)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念就是得到,通过计算浓度商和平衡常数比较分析判断反应进行的方向;
(5)燃料电池中,正极发生的反应是氧气得电子被还原的过程,负极是甲烷失电子生成二氧化碳;电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳.
(2)图象分析可知是逆反应速率增大,反应是否达到平衡不知,所以增大逆反应速率的因素均符合;
(3)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(4)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念就是得到,通过计算浓度商和平衡常数比较分析判断反应进行的方向;
(5)燃料电池中,正极发生的反应是氧气得电子被还原的过程,负极是甲烷失电子生成二氧化碳;电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳.
解答:
解:(1)图象分析反应是放热反应,反应的焓变=断裂化学键吸收的能量-形成化学键放出的热量=E1-E3,标注物质的聚集状态和对应反应的焓变写出热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H=(E1-E3)或-(E3-E1)kJ?mol-1 ,
故答案为:CO(g)+2H2(g)?CH3OH(g)△H=(E1-E3)或-(E3-E1)kJ?mol-1 ;
(2)图象分析可知是逆反应速率增大,反应是否达到平衡不知,所以增大逆反应速率的因素均符合,如加压、等倍增加反应物和生成物、增加甲醇浓度、升高温度、使用催化剂等,
故答案为:增加甲醇浓度;使用催化剂;
(3)判断反应达到平衡状态的依据正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
A.无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,故A错误;
B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故B错误;
C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故C正确;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故D正确;
E.容器内CO、H2、CH3OH的浓度之比为1:2:1,和起始量,变化量有关,不能作为平衡的标志,故E错误;
故选CD;
(4)在一定温度下,若将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,依据平衡三段式列式计算;
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) a 2a 0
变化量(mol/L)50%×a a 0.5a
平衡量(mol/L)0.5a a 0.5a
则该反应的平衡常数K=
=
;
若此时再向该容器中投入a mol CO、2a mol H2和a mol CH3OH,浓度为c(CO)=
mol/L+0.5amol/L=amol/L,c(H2)=
+amol/L=2a,c(CH3OH)=
mol/L+0.5amol/L=amol/L,Q=
=
<K=
,判断平衡移动的方向是反应正向进行;达到新平衡与原平衡相比,CO的物质的量浓度增大;
故答案为:
;正向移动;增大;
(4)燃料电池中,正极反应一定是氧气得电子,该电池的电解质环境是熔融碳酸盐,所以电极反应为:O2+2CO2+4e-=2CO32-,负极是燃料失电子生成二氧化碳,负极电极反应为:CH4+4CO32--8e-=5CO2+2H2O;
故答案为:CO2;CH4+4CO32--8e-=5CO2+2H2O.
故答案为:CO(g)+2H2(g)?CH3OH(g)△H=(E1-E3)或-(E3-E1)kJ?mol-1 ;
(2)图象分析可知是逆反应速率增大,反应是否达到平衡不知,所以增大逆反应速率的因素均符合,如加压、等倍增加反应物和生成物、增加甲醇浓度、升高温度、使用催化剂等,
故答案为:增加甲醇浓度;使用催化剂;
(3)判断反应达到平衡状态的依据正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
A.无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,故A错误;
B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故B错误;
C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故C正确;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故D正确;
E.容器内CO、H2、CH3OH的浓度之比为1:2:1,和起始量,变化量有关,不能作为平衡的标志,故E错误;
故选CD;
(4)在一定温度下,若将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,依据平衡三段式列式计算;
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) a 2a 0
变化量(mol/L)50%×a a 0.5a
平衡量(mol/L)0.5a a 0.5a
则该反应的平衡常数K=
| 0.5a |
| 0.5a×a |
| 1 |
| a2 |
若此时再向该容器中投入a mol CO、2a mol H2和a mol CH3OH,浓度为c(CO)=
| a |
| 2 |
| 2a |
| 2 |
| a |
| 2 |
| a |
| a×(2a)2 |
| 1 |
| 4a2 |
| 1 |
| a2 |
故答案为:
| 1 |
| a2 |
(4)燃料电池中,正极反应一定是氧气得电子,该电池的电解质环境是熔融碳酸盐,所以电极反应为:O2+2CO2+4e-=2CO32-,负极是燃料失电子生成二氧化碳,负极电极反应为:CH4+4CO32--8e-=5CO2+2H2O;
故答案为:CO2;CH4+4CO32--8e-=5CO2+2H2O.
点评:本题考查了影响化学平衡移动的因素、平衡状态的判断等知识点,热化学方程式书写与图象分析方法是解题关键,题目难度中等.

练习册系列答案
相关题目
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L.向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g.再将得到的沉淀灼烧至质量不再改变为止,得到固体p g.则下列关系正确的是( )
A、p=m+
| ||||
B、c=
| ||||
| C、n=m+17Vc | ||||
D、
|
下列实验方案中可行的事( )
| A、用溶解、过滤的方法分离CaCl2和NaCl的固体混合物 |
| B、用BaCl2除去NaOH溶液中混有的少量Na2SO4 |
| C、用酒精把碘水中的碘萃取出来 |
| D、用澄清石灰水检验CO中是否含有CO2 |
下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中没有形成π键的是( )
| A、CH≡CH |
| B、CO2 |
| C、BeCl2 |
| D、BF3 |
 (1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
(1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示. 据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.