题目内容
已知下列热化学方程式:
①H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1
②H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1
③C(s)+
O2(g)═CO(g)△H=-110.5kJ?mol-1
④C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
回答下列问题:
(1)H2的燃烧热△H为 ;C的燃烧热为 .
(2)燃烧1g H2生成液态水,放出的热量为 .
(3)已知CO的燃烧热为283.0kJ?mol-1,现有CO、H2和CO2组成的混合气体116.8L(标准状况),完全燃烧后放出总能量为867.9kJ,且生成18g液态水,则混合气体中H2为 L,CO在混合气体中的体积分数约为 (精确至小数点后2倍).
①H2(g)+
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③C(s)+
| 1 |
| 2 |
④C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
回答下列问题:
(1)H2的燃烧热△H为
(2)燃烧1g H2生成液态水,放出的热量为
(3)已知CO的燃烧热为283.0kJ?mol-1,现有CO、H2和CO2组成的混合气体116.8L(标准状况),完全燃烧后放出总能量为867.9kJ,且生成18g液态水,则混合气体中H2为
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:(1)燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物所放出的热量,水为液态水;
(2)根据热化学方程式的意义来解答;
(3)根据水的质量利用燃烧热计算氢气燃烧放出的热量,再根据一氧化碳放出的热量以及燃烧热计算一氧化碳体积,从而计算CO的体积分数.
(2)根据热化学方程式的意义来解答;
(3)根据水的质量利用燃烧热计算氢气燃烧放出的热量,再根据一氧化碳放出的热量以及燃烧热计算一氧化碳体积,从而计算CO的体积分数.
解答:
解:(1)燃烧热指1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,根据热化学方程式的含义,H2的标准燃烧热的热化学方程式为:H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1;C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1;
故答案为:-285.8kJ?mol-1;393.5kJ?mol-1;
(2)H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1表示2克氢气完全燃烧生成液态水,放出285.8kJ的热量,则燃烧1g H2生成液态水,放出的热量为142.9kJ,
故答案为:142.9kJ;
(3)n(H2O)=
=1mol,根据氢原子守恒得n(H2O)=n(H2)=1mol,则混合气体中H2为22.4L,根据H2(g)+
O2(g)=H2O(l)△H=-285.58KJ/mol知,氢气完全燃烧放出的热量是285.58KJ,则CO完全燃烧放出的热量=867.9KJ-285.8KJ=582.1kJ,
设CO的体积是x,
CO(g)+
O2(g)=CO2(g) 282.8KJ
22.4L 282.8KJ
x 582.1kJ
=
解得:x=46.1L,
所以CO在混合气体中的体积分数约为
=39%;
故答案为:22.4;39%;
| 1 |
| 2 |
故答案为:-285.8kJ?mol-1;393.5kJ?mol-1;
(2)H2(g)+
| 1 |
| 2 |
故答案为:142.9kJ;
(3)n(H2O)=
| 18g |
| 18g/mol |
| 1 |
| 2 |
设CO的体积是x,
CO(g)+
| 1 |
| 2 |
22.4L 282.8KJ
x 582.1kJ
| 22.4L |
| x |
| 282.8KJ |
| 582.1kJ |
所以CO在混合气体中的体积分数约为
| 46.1L |
| 116.8L |
故答案为:22.4;39%;
点评:本题考查了燃烧热的概念以及热化学反应方程式的计算,计算时先根据水的质量计算氢气放出的热量,再根据总热量计算CO完全燃烧放出的热量,最后根据热量与CO的关系式进行解答即可,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
下列4种鉴别碳酸钠和碳酸氢钠的方法中,不正确的是( )
| A、在等浓度溶液中滴加澄清石灰水观察是否有沉淀产生 |
| B、在少量固体样品中滴入几滴水,触摸试管看是否有温度变化 |
| C、在等浓度溶液中滴入几滴酚酞比较溶液颜色深浅 |
| D、取少量的固体试样加热后称量质量变化 |
已知柠檬醛的结构简式为 根据已有知识判定下列说法不正确的是
根据已有知识判定下列说法不正确的是
( )
 根据已有知识判定下列说法不正确的是
根据已有知识判定下列说法不正确的是( )
| A、它可使KMnO4溶液褪色 |
| B、它可跟银氨溶液生成银镜 |
| C、它可使溴水褪色 |
| D、它被催化加氢后最终产物的化学式为C10H20O |
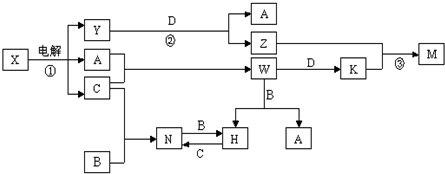
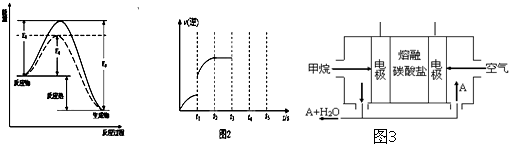
 (1)下列7种物质:
(1)下列7种物质: 石油是工业的血液,被誉为“黑色的金子”,是重要的能源资源和化工原料.
石油是工业的血液,被誉为“黑色的金子”,是重要的能源资源和化工原料.