题目内容
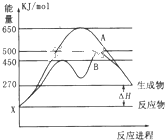 (1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
(1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.①当反应达到平衡后,其他条件不变,升高温度,反应物的转化率
②其中B历程表明此反应采用的条件为
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(2)常温下,如果取0.1mol?L-1HA溶液与0.1mol?L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8.
①混合液中pH=8的原因是
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH
考点:化学平衡的影响因素,酸碱混合时的定性判断及有关ph的计算
专题:化学平衡专题,电离平衡与溶液的pH专题
分析:(1)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度平衡向逆反应方向移动,据此解答;
②由图可知,反应历程B与A相比,改变反应历程,应是使用催化剂;
(2)①0.1mol?L-1 HA溶液与0.1mol?L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,则说明HA是弱酸,含有弱根离子的盐促进水电离;
②根据题意知,HA的酸性比碳酸强,NH4A溶液为中性,说明铵根离子和该酸根离子水解程度相同,由此得知铵根离子水解程度小于碳酸根离子,所以(NH4)2CO3中溶液呈碱性.
②由图可知,反应历程B与A相比,改变反应历程,应是使用催化剂;
(2)①0.1mol?L-1 HA溶液与0.1mol?L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,则说明HA是弱酸,含有弱根离子的盐促进水电离;
②根据题意知,HA的酸性比碳酸强,NH4A溶液为中性,说明铵根离子和该酸根离子水解程度相同,由此得知铵根离子水解程度小于碳酸根离子,所以(NH4)2CO3中溶液呈碱性.
解答:
解:(1)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度平衡向正反应方向移动,反应物的转化率增大,
故答案为:增大;
②由图可知,反应历程B与A相比,改变反应历程,应是使用催化剂,
故答案为:D;
(2)①0.1mol?L-1 HA溶液与0.1mol?L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,则说明HA是弱酸,含有弱根离子的盐中弱离子的水解,方程式为:A-+H2O?HA+OH-,故答案为:A-+H2O?HA+OH-;
②根据题意知,HA的酸性比碳酸强,NH4A溶液为中性,说明铵根离子和该酸根离子水解程度相同,由此得知铵根离子水解程度小于碳酸根离子,所以(NH4)2CO3中溶液呈碱性,所以pH>7,故答案为:>.
故答案为:增大;
②由图可知,反应历程B与A相比,改变反应历程,应是使用催化剂,
故答案为:D;
(2)①0.1mol?L-1 HA溶液与0.1mol?L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,则说明HA是弱酸,含有弱根离子的盐中弱离子的水解,方程式为:A-+H2O?HA+OH-,故答案为:A-+H2O?HA+OH-;
②根据题意知,HA的酸性比碳酸强,NH4A溶液为中性,说明铵根离子和该酸根离子水解程度相同,由此得知铵根离子水解程度小于碳酸根离子,所以(NH4)2CO3中溶液呈碱性,所以pH>7,故答案为:>.
点评:本题综合性较大,涉及平衡移动、电解质溶液有关计算、盐类水解等,难度中等,是对学生综合能力的考查,(2)为易错点,判断HA与碳酸酸性强弱是关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有关铁与水反应的说法中,正确的是( )
| A、在任何条件下,铁与水均不发生反应 |
| B、在高温时,铁与水蒸气反应生成氢氧化铁和氢气 |
| C、在高温时,铁与水蒸气反应生成氧化铁和氢气 |
| D、高温时铁与水蒸气反应生成四氧化三铁和氢气 |
可一次性鉴别氯化镁、氯化铝、碳酸钾等三种溶液的试剂是( )
| A、Ba(NO3)2溶液 |
| B、AgNO3溶液 |
| C、NaOH溶液 |
| D、CH3COOH溶液 |
据报载我国最近合成了多种元素的新的原子,测定了铪(Hf)元素的相对原子质量的新值.铪元素的核电荷数为72,相对原子质量为185,铪原子的中子数为( )
| A、72 | B、113 |
| C、185 | D、257 |
 环上的二溴取代物的种类有
环上的二溴取代物的种类有