题目内容
11.1914年报道的第一种常温离子液体硝酸乙基铵[(C2H5NH3)NO3],是通过HNO3与C2H5NH2反应制得,其熔点为12℃.下列有关硝酸乙基铵的说法正确的是( )| A. | 常温下能导电 | B. | 水溶液呈碱性 | ||
| C. | 是共价化合物 | D. | 能与NaOH反应产生NH3 |
分析 A.依据题意可知硝酸乙基铵为盐,属于离子化合物,属于电解质,熔点12℃;
B.强酸弱碱盐水解显酸性;
C.依据题意硝酸乙基铵常温离子液体可知其为离子晶体;
D.C2H5NH2的化学性质与NH3相似,(C2H5NH3)NO3能与NaOH反应生成C2H5NH2;
解答 解:A.常温下硝酸乙基铵为盐,属于离子化合物,常温下为液态,含有自由移动的离子,能够导电,故A正确;
B.硝酸乙基铵[(C2H5NH3)NO3],是通过HNO3与C2H5NH2反应制得,是强酸弱碱盐,水解显酸性,故B错误;
C.依据题意硝酸乙基铵常温离子液体,属于离子化合物,故C错误;
D.(C2H5NH3)NO3能与NaOH反应生成C2H5NH2,不能产生NH3,故D错误;
故选:A.
点评 本题考查了盐类水解,正确获取信息并灵活运用信息解答是解本题关键,再结合物质的结构、性质分析解答,题目难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
1.已知25℃时有关弱酸的电离平衡常数:
根据上述已知数据,回答下列问题:
(1)三种酸(CH3COOH、HCN、H2CO3)的酸性由强到弱的顺序是CH3COOH>H2CO3>HCN
(2)等物质的量的三种算的正盐(CH3COONa、NaCN、Na2CO3),其pH由大到小的顺序是Na2CO3溶液>NaCN溶液>CH3COONa溶液.
(3)常温下,体积为10ml pH=2的CH3COOH溶液与HCN溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者>后者(填“>”、“<”或“=”).
(4)用电离方程式表示NaCN溶液显碱性的原因CN-+H2O?HCN+OH-,其溶液中离子浓度由大到小的关系是c(Na+)>c(CN-)>c(OH-)>c(H+).
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
(1)三种酸(CH3COOH、HCN、H2CO3)的酸性由强到弱的顺序是CH3COOH>H2CO3>HCN
(2)等物质的量的三种算的正盐(CH3COONa、NaCN、Na2CO3),其pH由大到小的顺序是Na2CO3溶液>NaCN溶液>CH3COONa溶液.
(3)常温下,体积为10ml pH=2的CH3COOH溶液与HCN溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者>后者(填“>”、“<”或“=”).
(4)用电离方程式表示NaCN溶液显碱性的原因CN-+H2O?HCN+OH-,其溶液中离子浓度由大到小的关系是c(Na+)>c(CN-)>c(OH-)>c(H+).
2.下列关于结构式的叙述中正确的是( )
| A. | 表示组成分子中的各原子在空间的位置 | |
| B. | 以共价键相连的两原子间总以一条短线相连 | |
| C. | 结构式和球棍模型在表示分子结构上作用相同 | |
| D. | 用一条短线表示一对共用电子对的图式反映共价分子中各原子的连接顺序 |
19.化学与生活密切相关.下列有关说法错误的是( )
| A. | 大量排放含氮、磷的生活污水可使水体富营养化 | |
| B. | “曾青得铁,则化为铜”是描述金属间的置换反应 | |
| C. | 光化学姻雾的形成主要与硫氧化物的排放有关 | |
| D. | 硅是光伏太阳能电池的光电半导体材料 |
6.短周期元素Q、W、X、Y、Z在元素周期表中的位置如表格所示,Z元素的简单离子半径在本周期中最小,下列说法不正确的是( )
| X | Y | |||
| Z | W | Q |
| A. | 离子半径的大小顺序为r(Q-)>r(W2-)>r(Z3+)>r(Y2-) | |
| B. | X、Q的氢化物化合的产物中既含共价键又含离子键 | |
| C. | Y氢化物的沸点比W氢化物的沸点高 | |
| D. | X、Z、W、Q的最高价氧化物对应的水化物均能与强碱反应 |
16.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4L的CH3Cl中所含质子数为26NA | |
| B. | 将100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒的数目为0.01NA | |
| C. | 常温下,1L0.1mol/L醋酸中含有的离子总数为0.2NA | |
| D. | 0.1molC2H2气体中,原子间含有的共用电子对数目为0.3NA |
3.对下列图象的描述正确的是( )
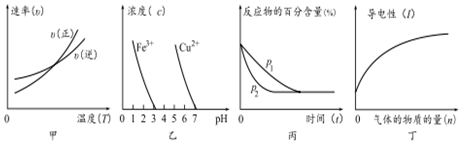
①根据图甲可判断反应的△H<0
②根据图乙,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
③图丙可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响
④图丁可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化的愔况.

①根据图甲可判断反应的△H<0
②根据图乙,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
③图丙可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响
④图丁可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化的愔况.
| A. | ①③ | B. | ②④ | C. | ③④ | D. | ①② |
20.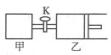 如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )
如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )
 如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )
如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )| A. | 甲中反应的平衡常数小于乙 | |
| B. | 当乙中A与B的体积分数之比为1:2时,反应达到平衡状态 | |
| C. | 平衡时甲容器中A的物质的量小于0.55 mol | |
| D. | 若打开活塞K,达平衡时乙容器的体积为3.2 L |