题目内容
3.对下列图象的描述正确的是( )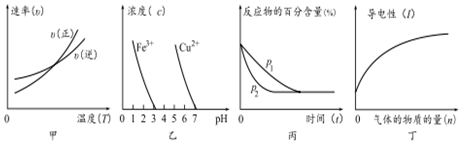
①根据图甲可判断反应的△H<0
②根据图乙,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
③图丙可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响
④图丁可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化的愔况.
| A. | ①③ | B. | ②④ | C. | ③④ | D. | ①② |
分析 ①交叉点后,升高温度,正反应速率大于逆向反应速率,平衡正向移动;
②由图可知,pH大于3时铁离子沉淀完全,pH为5时铜离子开始沉淀;
③该反应为气体体积减小的反应,增大压强,平衡正向移动;
④向醋酸溶液中通入氨气时,生成强电解质醋酸铵,离子浓度增大.
解答 解:①交叉点后,升高温度,正反应速率大于逆向反应速率,平衡正向移动,则△H>0.,故错误;
②由图可知,pH大于3时铁离子沉淀完全,pH为5时铜离子开始沉淀,则去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5,故正确;
③该反应为气体体积减小的反应,增大压强,平衡正向移动,则不能为压强,应为催化剂对反应2A(g)+2B(g)?3C(g)+D(s)的影响,故错误;
④向醋酸溶液中通入氨气时,生成强电解质醋酸铵,离子浓度增大,则丁为溶液导电性随氨气量的变化图,故正确;
故选B.
点评 本题考查反应热与焓变、弱电解质的电离,为高频考点,把握平衡移动、难溶电解质等为解答的关键,侧重分析与应用能力的考查,注意图象的分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.单质Z是一种常见的半导体材料,可由X通过如图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:
X$→_{加热}^{Mg}$Mg2Z$\stackrel{盐酸}{→}$Y$\stackrel{加热}{→}$Z
下列说法正确的是( )
X$→_{加热}^{Mg}$Mg2Z$\stackrel{盐酸}{→}$Y$\stackrel{加热}{→}$Z
下列说法正确的是( )
| A. | X为酸性氧化物,能与碱反应,不能与酸反应 | |
| B. | Y的化学式为SiH4 | |
| C. | X、Z都含有非极性共价键 | |
| D. | X与Mg在加热条件下反应的化学方程式为SiO2+2Mg$\frac{\underline{\;△\;}}{\;}$2MgO+Si |
11.1914年报道的第一种常温离子液体硝酸乙基铵[(C2H5NH3)NO3],是通过HNO3与C2H5NH2反应制得,其熔点为12℃.下列有关硝酸乙基铵的说法正确的是( )
| A. | 常温下能导电 | B. | 水溶液呈碱性 | ||
| C. | 是共价化合物 | D. | 能与NaOH反应产生NH3 |
18.下列有关离子方程式正确的是( )
| A. | 将氟气通入水中:F2+H2O═H++F++HFO | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
15.W、X、Y、Z是原子序数依次增大的短周期元素,W是原子半径最小的短周期元素,W、Y同主族,X、Z同主族,且X、Z的原子序数之和是W、Y原子序数之和的2倍.下列说法中不正确的是( )
| A. | W和X形成的化合物可能含有非极性共价键 | |
| B. | X和Z形成的化合物常温下为固态 | |
| C. | W、X、Y、Z四种元素组成的化合物的水溶液可能呈酸性 | |
| D. | W、X、Y、Z四种元素两两之间均能形成二元化合物 |
12.可测出某84消毒液的pH为10.2是( )
| A. | pH试纸 | B. | 红色石蕊试纸 | ||
| C. | 数字pH计 | D. | 以酚酞为指示剂进行酸碱中和滴定 |
17.下列关于有机物的说法正确的是( )
| A. | 乙烯生成乙烷、乙醇生成乙醛均属于加成反应 | |
| B. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| C. | 蚕丝和人造纤维均为高分子化合物,用灼烧的方法可区别 | |
| D. | 葡萄糖和果糖的分子式均为C6H12O6,二者互为同系物 |
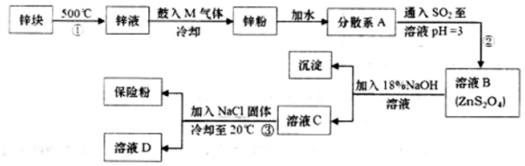
 ;悬浊液; (填“溶液”“胶体”或“悬浊液”).
;悬浊液; (填“溶液”“胶体”或“悬浊液”).