题目内容
5.用单线桥标出下列反应中电子转移的方向和数自,并填空2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O
氧化剂是KClO3;被氧化的物质是HCl;产生0.1mol Cl2,则转移的电子的物质的量为$\frac{1}{6}$mol.
分析 反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,当有3mol Cl2生成时,转移5mol电子,以此解答该题.
解答 解:该反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,HCl中Cl元素化合价由-1价升高到0价被氧化,化合价降低值=化合价升高值=转移电子数=5,电子转移方向和数目为: ,当有3mol Cl2生成时,转移5mol电子,则产生0.1mol Cl2,转移的电子的物质的量为$\frac{1}{6}$mol;
,当有3mol Cl2生成时,转移5mol电子,则产生0.1mol Cl2,转移的电子的物质的量为$\frac{1}{6}$mol;
故答案为: ;KClO3;3Cl2;$\frac{1}{6}$.
;KClO3;3Cl2;$\frac{1}{6}$.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意从元素化合价的角度分析,能用单线桥标出电子转移的方向和数目,难度不大.

练习册系列答案
相关题目
11.1914年报道的第一种常温离子液体硝酸乙基铵[(C2H5NH3)NO3],是通过HNO3与C2H5NH2反应制得,其熔点为12℃.下列有关硝酸乙基铵的说法正确的是( )
| A. | 常温下能导电 | B. | 水溶液呈碱性 | ||
| C. | 是共价化合物 | D. | 能与NaOH反应产生NH3 |
12.可测出某84消毒液的pH为10.2是( )
| A. | pH试纸 | B. | 红色石蕊试纸 | ||
| C. | 数字pH计 | D. | 以酚酞为指示剂进行酸碱中和滴定 |
13.已知AgCl、AgBr及AgI的ksp依次为Ksp依次为1.6×10-10、4.8×10-13、1.6×10-16.现将物质的量均为1.5×10-2mol的NaI、NaBr、NaCl和molAgNO3混合配成1.0L水溶液,达到平衡时,下列说法正确的是( )
| A. | 只生成AgBr及AgI两种沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol•L-1 | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol•L-1 | D. | 溶液中c(Ag+)≈3.2×10-8mol•L-1 |
20.下列实验操作所对应的现象和结论都确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将SO2通入Ba(NO3)2溶液中 | 溶液出现浑浊 | 沉淀的主要成分是BaSO3 |
| B | 将少量溴水滴入FeI2溶液中,再加入CCl4振荡,静置 | 下层呈紫红色 | 氧化性:I2>Fe3+ |
| C | 将少量浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 硝酸的还原产物是NO2 |
| D | 将CO2通入Na2SiO3溶液中 | 有白色沉淀生成 | H2CO3酸性比H2SiO3强 |
| A. | A | B. | B | C. | C | D. | D |
10.下列反应中,熵显著增加的是( )
| A. | CO(g)+2H2(g)=CH3OH(g) | |
| B. | CaCO3(g)+2HCl(aq)=CaCl2(aq)+H2O(l)+CO2(g) | |
| C. | C(s)+O2(g)=CO2(g) | |
| D. | 2Hg(l)+O2(g)=2HgO(s) |
17.下列关于有机物的说法正确的是( )
| A. | 乙烯生成乙烷、乙醇生成乙醛均属于加成反应 | |
| B. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| C. | 蚕丝和人造纤维均为高分子化合物,用灼烧的方法可区别 | |
| D. | 葡萄糖和果糖的分子式均为C6H12O6,二者互为同系物 |
14.若金属钠引起火灾,则下列物质或方法中可用于灭火的是( )
| A. | 水 | B. | 湿布 | C. | 干砂 | D. | 泡沫灭火器 |
15.二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备.某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图:
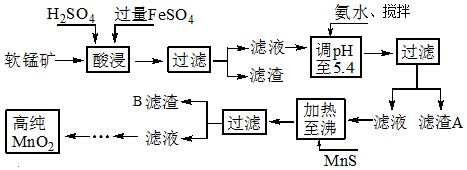
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.3,恰好能使Fe3+、Al3+沉淀完全.
(3)滤渣B的成分是CuS、ZnS.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-═MnOOH+OH-.
(5)MnO2也可在MnSO4•H2SO4•H2O为体系的电解液中电解获得,其阳极电极反应式为Mn2+-2e-+2H2O═MnO2+4H+
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-).计算可得该样品纯度为94.6%.

| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-34 | 10-16 | 10-38 |
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.3,恰好能使Fe3+、Al3+沉淀完全.
(3)滤渣B的成分是CuS、ZnS.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-═MnOOH+OH-.
(5)MnO2也可在MnSO4•H2SO4•H2O为体系的电解液中电解获得,其阳极电极反应式为Mn2+-2e-+2H2O═MnO2+4H+
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-).计算可得该样品纯度为94.6%.