题目内容
5.检验淀粉是否开始水解需用下列试剂中的( )| A. | 碘化钾淀粉溶液 | B. | 碘水 | ||
| C. | 银氨溶液和氢氧化钠溶液 | D. | 氢氧化钠溶液 |
分析 淀粉水解生成葡萄糖,检验葡萄糖在碱性条件下发生银镜反应,以此来解答.
解答 解:A.碘化钾淀粉溶液不能检验葡萄糖,故A不选;
B.碘水不能检验葡萄糖,故B不选;
C.粉水解生成葡萄糖,检验葡萄糖在碱性条件下发生银镜反应,则需要试剂为银氨溶液和氢氧化钠溶液,故C选;
D.只有NaOH溶液不能检验葡萄糖,故D不选;
故选C.
点评 本题考查有机物的检验和鉴别,为高频考点,把握淀粉水解生成葡萄糖、葡萄糖的还原性为解答的关键,侧重分析与应用能力的考查,注意水解反应及氧化反应,题目难度不大.

练习册系列答案
相关题目
16.碱金属元素具有相似的化学性质,是由于它们的原子具有相同的( )
| A. | 原子半径 | B. | 电子层数 | C. | 核外电子数 | D. | 最外层电子数 |
13.有机物 是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
 是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )| A. | 18种 | B. | 15种 | C. | 13种 | D. | 6种 |
20.能和对苯二甲酸发生缩聚反应的化合物是( )
| A. | 苯酚 | B. | 甲醛 | C. | 乙醇 | D. | 乙二醇 |
10.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
17.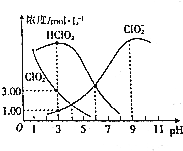 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )
 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | HClO2的电离平衡常数Ka=10-6 | |
| C. | pH=3时,c(Cl-)>c(ClO2-) | |
| D. | pH=4时,c(Cl-)+c(ClO2-)-c(Na+)=10-4-10-10 |
16.a、b、c、d、e、f、g、h为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;d是四原子分子,h是五原子分子;c与f作用可生成2个中性分子g.下列说法不正确的是( )
| 微粒代码 | a | b | c | d | e | f | g | h |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 | 0 |
| A. | b对应元素的最高价氧化物的水化物的碱性比e强 | |
| B. | d的水溶液显碱性 | |
| C. | H具有可燃性 | |
| D. | e相应的元素的单质与g微粒任何条件下都不能反应 |
17.短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A. | B与A只能组成化合物BA3 | |
| B. | C、D、E形成的化合物与A、B、C形成的化合物可能发生氧化还原反应 | |
| C. | A2C2和D2C2具有完全相同类型的化学键 | |
| D. | E的最高价氧化物对应的水化物一定具有强的氧化性 |