题目内容
13.有机物 是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )| A. | 18种 | B. | 15种 | C. | 13种 | D. | 6种 |
分析 有机物 的不饱和度为5,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基,所以剩余2个碳原子,取代基可以为:-CH2CH2COOH和-NH2,-CH(COOH)CH3和-NH2,-CH2CH2NH2和-COOH,-CH(NH2)CH3和-COOH,--CH2(NH2)COOH和-CH3,-CH2COOH和-CH2NH2,两个取代基又分为邻、间、对三种情况.
的不饱和度为5,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基,所以剩余2个碳原子,取代基可以为:-CH2CH2COOH和-NH2,-CH(COOH)CH3和-NH2,-CH2CH2NH2和-COOH,-CH(NH2)CH3和-COOH,--CH2(NH2)COOH和-CH3,-CH2COOH和-CH2NH2,两个取代基又分为邻、间、对三种情况.
解答 解:有机物 的不饱和度为5,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基,所以剩余2个碳原子,取代基可以为:-CH2CH2COOH和-NH2,-CH(COOH)CH3和-NH2,-CH2CH2NH2和-COOH,-CH(NH2)CH3和-COOH,-CH2(NH2)COOH和-CH3,-CH2COOH和-CH2NH2,两个取代基又分为邻、间、对三种,所以同分异构体为6×3=18,故选A.
的不饱和度为5,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基,所以剩余2个碳原子,取代基可以为:-CH2CH2COOH和-NH2,-CH(COOH)CH3和-NH2,-CH2CH2NH2和-COOH,-CH(NH2)CH3和-COOH,-CH2(NH2)COOH和-CH3,-CH2COOH和-CH2NH2,两个取代基又分为邻、间、对三种,所以同分异构体为6×3=18,故选A.
点评 本题主要考查同分异构体的书写,难度中等,注意支链的确定是解题的关键.

练习册系列答案
相关题目
3.下列各化合物的命名中正确的是( )
| A. | CH2═CH-CH═CH2 1,3-二丁烯 | B. | CH3-CH2-CH═CH2 3-丁烯 | ||
| C. |  对二甲苯 对二甲苯 | D. |  3-甲基丁烷 3-甲基丁烷 |
4.对于A2+3B2=2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(A2)=0.4 mol•L-1•s-1 | B. | v(B2)=0.8 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=0.6 mol•L-1•min-1 |
1.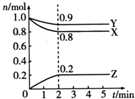 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.下列描述正确的是( )
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.下列描述正确的是( )
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.下列描述正确的是( )
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.下列描述正确的是( )| A. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) | |
| B. | 反应开始到2min,X的物质的量浓度减少了0.4 mol•L-1 | |
| C. | 反应开始到2min,用Y表示的反应速率为0.1mol•L-1•min-1 | |
| D. | 反应到2min时,Z的物质的量浓度为0.2mol•L-1 |
8.葡萄酒中常用Na2S2O5做抗氧化剂,0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图所示,对该溶液的下列说法中正确的是( )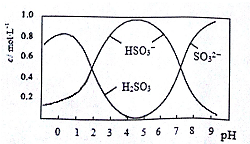

| A. | 向pH=4的溶液中滴加BaCl2溶液,会有白色沉淀产生 | |
| B. | pH=4.5时c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | pH=5时c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) | |
| D. | 向pH=5.5的溶液中滴加溴水,反应的离子方程式为H2SO3+Br2+H2O=4H++SO42-+2Br- |
5.检验淀粉是否开始水解需用下列试剂中的( )
| A. | 碘化钾淀粉溶液 | B. | 碘水 | ||
| C. | 银氨溶液和氢氧化钠溶液 | D. | 氢氧化钠溶液 |
4.草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)如果研究催化剂对化学反应速率的影响,应使用实验Ⅰ和Ⅱ(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,应使用实验Ⅰ和Ⅲ.
(2)对比实验Ⅰ和Ⅳ,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H 2C2O4)浓度不变和总体积不变.
(3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
①用托盘天平称取W g Na2C2O4晶体.(Na2C2O4相对分子质量为134)
②将WgNa2C2O4配成100mL标准溶液,置于锥形瓶中,
酸性KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中.
③若酸性KMnO4消耗了40mL,则酸性KMnO4的物质的浓度为$\frac{W}{13.4}$ mol/L(填表达式,用W表示).
| 组别 | 10%硫酸溶液的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
(2)对比实验Ⅰ和Ⅳ,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H 2C2O4)浓度不变和总体积不变.
(3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
①用托盘天平称取W g Na2C2O4晶体.(Na2C2O4相对分子质量为134)
②将WgNa2C2O4配成100mL标准溶液,置于锥形瓶中,
酸性KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中.
③若酸性KMnO4消耗了40mL,则酸性KMnO4的物质的浓度为$\frac{W}{13.4}$ mol/L(填表达式,用W表示).
5.W粒子的结构如图所示,下列关于它的说法不正确的是( )
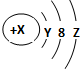
| A. | Y=2 | |
| B. | 若X=18,则Z=8 | |
| C. | 若X=17,它的最高价氧化物化学式为W2O7 | |
| D. | 若X=14,它的氢化物的化学式为H2W |