题目内容
17.短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )| A. | B与A只能组成化合物BA3 | |
| B. | C、D、E形成的化合物与A、B、C形成的化合物可能发生氧化还原反应 | |
| C. | A2C2和D2C2具有完全相同类型的化学键 | |
| D. | E的最高价氧化物对应的水化物一定具有强的氧化性 |
分析 短周期中的A、B、C、D、E五种元素,原子序数依次增大,C2-与D+的核外电子数相等,结合所带电荷可知,C为O元素、D为Na;A和D,C和E分别同主族,A为非金属元素,则A为H元素、E为S元素;A与B的原子序数之和等于C的原子序数,则B的原子序数=8-1=7,故B为N元素,然后结合元素周期律及元素化合物知识来解答.
解答 解:短周期中的A、B、C、D、E五种元素,原子序数依次增大,C2-与D+的核外电子数相等,结合所带电荷可知,C为O元素、D为Na;A和D,C和E分别同主族,A为非金属元素,则A为H元素、E为S元素;A与B的原子序数之和等于C的原子序数,则B的原子序数=8-1=7,故B为N元素.
A.N与H能组成NH3、N2H4等多种化合物,故A错误;
B.由C、D、E三元素形成的化合物为硫酸钠、亚硫酸钠,A、B、C三元素形成的化合物有硝酸,硝酸能与亚硫酸钠可发生氧化还原反应,故B正确;
C.A2C2为H2O2,只含共价键,而D2C2为过氧化钠,过氧化钠中含有离子键、共价键,故C错误;
D.E的最高价氧化物对应的水化物为硫酸,若为稀硫酸,不具有强的氧化性,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答的关键,侧重分析与推断能力的考查,注意元素周期律及元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
5.检验淀粉是否开始水解需用下列试剂中的( )
| A. | 碘化钾淀粉溶液 | B. | 碘水 | ||
| C. | 银氨溶液和氢氧化钠溶液 | D. | 氢氧化钠溶液 |
5.W粒子的结构如图所示,下列关于它的说法不正确的是( )
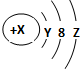
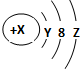
| A. | Y=2 | |
| B. | 若X=18,则Z=8 | |
| C. | 若X=17,它的最高价氧化物化学式为W2O7 | |
| D. | 若X=14,它的氢化物的化学式为H2W |
12.下列反应中乙醛作氧化剂的是( )
| A. | 乙醛与氢气反应 | B. | 乙醛与银氨溶液反应 | ||
| C. | 乙醛与氧气反应 | D. | 乙醛与新制Cu(OH)2反应 |
2.已知X、Y、Z、R均为短周期元素,其中X与R为同族元素,且X的元素原子序数是R原子序数的2倍,X、Y处于同一周期,Y的原子半径是本周期元素原子中最大的,Z元素是所有元素中非金属性最强的元素.下列说法不正确的是( )
| A. | 原子最外层电子数:Z>X=R>Y | |
| B. | Z与R形成的化合物中R显正价 | |
| C. | 离子半径:X2->Y+>R2->Z- | |
| D. | 四种元素中X元素形成的氢化物沸点最低 |
9.下列粒子半径最小的是( )
| A. | Na+ | B. | Mg2+ | C. | S2- | D. | Cl- |
7.某温度下,已知醋酸的电离常数Ka=1.8×10-5,醋酸银的溶度积常数Ksp=1.6×10-3,碳酸银的溶度积常数Ksp=8.3×10-12,在不考虑盐类水解的情况下,下列有关说法正确的是( )
| A. | 该温度下醋酸银的溶解度约为0.668g | |
| B. | 该温度下饱和醋酸水溶液的pH=2.5-$\frac{1}{2}$lg1.8 | |
| C. | 某溶液中含有CH3COO-和CO32-,浓度均为0.01mol/L,向其中逐滴加入0.01 mol/L的AgNO3溶液,CH3COO-离子先产生沉淀 | |
| D. | 醋酸溶液加水稀释后,溶液中导电粒子的数目减少 |
 .
.