题目内容
16.a、b、c、d、e、f、g、h为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:| 微粒代码 | a | b | c | d | e | f | g | h |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 | 0 |
| A. | b对应元素的最高价氧化物的水化物的碱性比e强 | |
| B. | d的水溶液显碱性 | |
| C. | H具有可燃性 | |
| D. | e相应的元素的单质与g微粒任何条件下都不能反应 |
分析 a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子.a为单核,电荷为0,则a为Ne原子;b为单核,电荷为1+,则b为Na+;c为双核,电荷为1-,则c为OH-;d为多核,电荷为0,d是四原子分子,则d为NH3;e为单核,电荷为2+,则e为 Mg2+;f为多核,电荷为1+,OH-与f作用可生成2个中性分子g,g为多核,电荷为0,则f为H3O+,g为H2O;h是五原子分子,则h为CH4,据此结合元素化合物的性质解答.
解答 解:a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子.a为单核,电荷为0,则a为Ne原子;b为单核,电荷为1+,则b为Na+;c为双核,电荷为1-,则c为OH-;d为多核,电荷为0,d是四原子分子,则d为NH3;e为单核,电荷为2+,则e为 Mg2+;f为多核,电荷为1+,OH-与f作用可生成2个中性分子g,g为多核,电荷为0,则f为H3O+,g为H2O,
A.b对应的元素为Na,e对应的元素为Mg,它们最高价氧化物的水化物分别为NaOH、Mg(OH)2,碱性:NaOH>Mg(OH)2,故A正确;
B.d为NH3,NH3溶于水生成一水合氨,溶液显碱性,故B正确;
C.h为CH4,具有可燃性,故C正确;
D.e对应元素为Mg元素,在加热条件下,能与H2O反应生成氢氧化镁和氢气,故D错误;
故选D.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,注意掌握常见10电子微粒,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
4.对于A2+3B2=2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(A2)=0.4 mol•L-1•s-1 | B. | v(B2)=0.8 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=0.6 mol•L-1•min-1 |
5.检验淀粉是否开始水解需用下列试剂中的( )
| A. | 碘化钾淀粉溶液 | B. | 碘水 | ||
| C. | 银氨溶液和氢氧化钠溶液 | D. | 氢氧化钠溶液 |
4.草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)如果研究催化剂对化学反应速率的影响,应使用实验Ⅰ和Ⅱ(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,应使用实验Ⅰ和Ⅲ.
(2)对比实验Ⅰ和Ⅳ,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H 2C2O4)浓度不变和总体积不变.
(3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
①用托盘天平称取W g Na2C2O4晶体.(Na2C2O4相对分子质量为134)
②将WgNa2C2O4配成100mL标准溶液,置于锥形瓶中,
酸性KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中.
③若酸性KMnO4消耗了40mL,则酸性KMnO4的物质的浓度为$\frac{W}{13.4}$ mol/L(填表达式,用W表示).
| 组别 | 10%硫酸溶液的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
(2)对比实验Ⅰ和Ⅳ,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H 2C2O4)浓度不变和总体积不变.
(3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
①用托盘天平称取W g Na2C2O4晶体.(Na2C2O4相对分子质量为134)
②将WgNa2C2O4配成100mL标准溶液,置于锥形瓶中,
酸性KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中.
③若酸性KMnO4消耗了40mL,则酸性KMnO4的物质的浓度为$\frac{W}{13.4}$ mol/L(填表达式,用W表示).
11.某实验小组以H2O2分解为例,探究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.下列说法不正确的是( )
| 编号 | 反应物 | 催化剂 | 温度 |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1mL0.1mol/LFeCl3溶液 | 40℃ |
| A. | 实验④反应速率最快 | |
| B. | 实验①反应速率最慢 | |
| C. | 实验②速率小于实验④的速率,只是因为实验④加入了催化剂 | |
| D. | 加入催化剂,能增大活化分子百分数,从而加快化学反应速率 |
1.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
(1)在这些元素中,化学性质最不活泼的是Ne,元素原子半径最小的是H,被称为“国防金属”的是Mg,被称为“生命元素”的是P,单质氧化性最强的元素是F.
(2)元素②的一种同位素(含8个中子)可测定文物年代,这种同位素的符号是${\;}_{6}^{14}$C.
(3)在上述元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是KOH.酸性最强的化合物的化学式是HClO4.
(4)写出③的气态氢化物与其最高价氧化物对应水化物反应的方程式NH3+HNO3=NH4NO3.
(5)元素④的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 3 | ⑦ | ⑧ | ⑨ | |||||
| 4 | ⑩ |
(2)元素②的一种同位素(含8个中子)可测定文物年代,这种同位素的符号是${\;}_{6}^{14}$C.
(3)在上述元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是KOH.酸性最强的化合物的化学式是HClO4.
(4)写出③的气态氢化物与其最高价氧化物对应水化物反应的方程式NH3+HNO3=NH4NO3.
(5)元素④的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
5.W粒子的结构如图所示,下列关于它的说法不正确的是( )
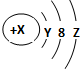
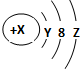
| A. | Y=2 | |
| B. | 若X=18,则Z=8 | |
| C. | 若X=17,它的最高价氧化物化学式为W2O7 | |
| D. | 若X=14,它的氢化物的化学式为H2W |
 .
.