题目内容
15.常温下有浓度均为0.1mol•L-1的三种溶液:①Na2CO3、②NaHCO3、③HCl(1)溶液②中按物质的量浓度由大到小顺序排列该溶液中各离子浓度c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(2)溶液②中,c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1;
(3)将10mL溶液③加水稀释至100mL,则此时溶液中由水电离出的c( H+)=10-12mol•L-1.
分析 (1)碳酸氢钠溶液中碳酸氢根离子的水解程度大于电离程度,显示碱性;
(2)溶液②中存在物料守恒.n(Na)=n(C);
(3)取10mL溶液③,加水稀释到100mL,溶液浓度为原来的$\frac{1}{10}$,为0.01mol/L.
解答 解:(1)碳酸氢钠溶液中碳酸氢根离子的水解程度大于电离程度,显示碱性,即c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(2)溶液②NaHCO3中存在物料守恒,溶液中碳元素所有存在形式浓度总和等于钠离子浓度,得到c(CO32-)+c(HCO3-)+c(H2CO3)=c(Na+)=0.1mol/L,
故答案为:0.1;
(3)取10mL溶液③,加水稀释到100mL,溶液浓度为原来的$\frac{1}{10}$,为0.01mol/L,由Kw=c(OH-)•c(H+)可知,c(OH-)=10-12 mol•L-1,则此时溶液中由水电离出的c(H+)=10-12 mol•L-1,
故答案为:10-12.
点评 本题考查较为综合,涉及弱电解质的电离和盐类的水解等问题,综合考查学生的化学知识应用能力和分析能力,题目难度中等.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
5.如果慢慢把下列溶液加热蒸干并灼烧,可以得到该溶液溶质固体的是( )
| A. | 高锰酸钾 | B. | 亚硫酸钠 | C. | 氯化铁 | D. | 碳酸钾 |
6.有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚乙烯;⑧环己烯.其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是( )
| A. | ①②③⑤ | B. | ④⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②③⑤⑧ |
3.下列各化合物的命名中正确的是( )
| A. | CH2═CH-CH═CH2 1,3-二丁烯 | B. | CH3-CH2-CH═CH2 3-丁烯 | ||
| C. |  对二甲苯 对二甲苯 | D. |  3-甲基丁烷 3-甲基丁烷 |
10.下列物质与其用途不完全符合的有( )
①干冰-人工降雨;
②Na2CO3-制玻璃;
③Fe2O3-红色油漆或涂料;
④Al2O3-耐火材料;
⑤NaClO-净水剂
⑥NaHCO3-制食品发泡剂;
⑦KAl(SO4)2-消毒、净水.
①干冰-人工降雨;
②Na2CO3-制玻璃;
③Fe2O3-红色油漆或涂料;
④Al2O3-耐火材料;
⑤NaClO-净水剂
⑥NaHCO3-制食品发泡剂;
⑦KAl(SO4)2-消毒、净水.
| A. | ⑤⑦ | B. | ②④⑥⑧ | C. | ③④ | D. | ①③⑤⑦ |
20.量取20.00mL0.03mol/LX溶液于锥形瓶中,用滴定管逐滴滴入0.03mol/L的Y溶液,溶液的pH变化曲线如图所示,下列说法正确的是( )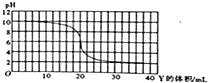

| A. | X和Y可能是KOH和CH3COOH | |
| B. | X和Y可能是NH3•H2O和HCl | |
| C. | X和Y恰好中和时,溶液呈中性 | |
| D. | X和Y恰好完全反应时的溶液中由水电离出的c(H+)=1×10-8mol/L |
4.对于A2+3B2=2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(A2)=0.4 mol•L-1•s-1 | B. | v(B2)=0.8 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=0.6 mol•L-1•min-1 |
5.检验淀粉是否开始水解需用下列试剂中的( )
| A. | 碘化钾淀粉溶液 | B. | 碘水 | ||
| C. | 银氨溶液和氢氧化钠溶液 | D. | 氢氧化钠溶液 |