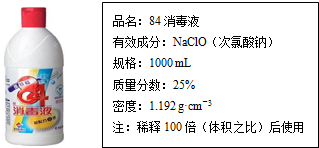
题目内容
12.(1)写出下列反应的化学方程式①过氧化钠与二氧化碳:2Na2O2+2CO2═2Na2CO3+O2
②碳与浓硫酸:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(2)下列两组溶液分别选用一种试剂鉴别,写出试剂的化学式.
①NaCl Na2CO3 Na2SiO3 Na2SO3 试剂:盐酸
②Na2SO4、Al2(SO4)3、FeCl2、(NH4)2SO4试剂:氢氧化钡溶液
(3)除去表内各物质中含有的少量杂质,写出除杂试剂,并填写分离方法和反应的离子方程式.
| 序号 | 物质 | 杂质 | 所加试剂 | 分离方法 | 离子方程式 |
| 1. | NO | NO2 | |||
| 2. | Fe粉 | Al粉 |
2MnO4-+5H2O2+6H+2Mn2++5O2↑+8H2O.
分析 (1)①过氧化钠与二氧化碳反应生成碳酸钠和氧气;
②碳与浓硫酸在加热条件下发生氧化还原反应生成二氧化碳、二氧化硫和水;
(2)①阴离子不同,可用酸检验;
②铵根离子可用检验氢氧根离子,硫酸根离子可用钡离子检验;
(3)二氧化氮和水反应生成硝酸和NO;铝可与氢氧化钠溶液反应;
(4)利用化合价升降相等进行配平,然后利用电荷守恒和观察法确定未知物,配平化学方程式.
解答 解:(1)①过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为2Na2O2+2CO2═2Na2CO3+O2,故答案为:2Na2O2+2CO2═2Na2CO3+O2;
②浓硫酸和C反应生成二氧化碳、二氧化硫和水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)①阴离子不同,可加入盐酸检验,现象分别是NaCl无现象、Na2CO3生成无色无味气体、Na2SiO3生成白色沉淀、Na2SO3生成刺激性气体,可鉴别,
故答案为:盐酸;
②铵根离子可用检验氢氧根离子,硫酸根离子可用钡离子检验,可应加入氢氧化钡,Na2SO4、Al2(SO4)3、FeCl2、(NH4)2SO4现象依次是生成白色沉淀;先生成沉淀后溶解;生成白色沉淀迅速变为灰绿色,最终变为红褐色、生成刺激性气味的气体,
故答案为:氢氧化钡溶液;
(3)二氧化氮和水反应生成硝酸和NO,可用洗气的方法除杂,反应的离子方程式为3NO2+2H2O=2H++2NO3-+NO,铝可与氢氧化钠溶液反应,然后过滤可除杂,反应的离子方程式为2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:
| 序号 | 物质 | 杂质 | 所加试剂 | 分离方法 | 离子方程式 |
| 1. | NO | NO2 | 水 | 洗气 | 3NO2+2H2O=2H++2NO3-+NO |
| 2. | Fe粉 | Al粉 | 氢氧化钠溶液 | 过滤 | 2Al+2H2O+2OH-═2AlO2-+3H2↑ |
故答案为:2;5;6;2;5;8H2O.
点评 本题考查较为综合,涉及元素化合物知识、物质的分离、提纯以及氧化还原反应的配平等知识,为小综合,多角度考查学生的双基,难度不大,注意相关基础知识的积累.

 名校课堂系列答案
名校课堂系列答案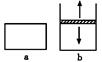
| A. | x的值为2 | |
| B. | B物质可为固体或液体 | |
| C. | 平衡时,a容器的体积小于V L | |
| D. | a、b容器中从起始到平衡所需时间相同 |
| A. | Fe3+ | B. | Cl- | C. | Al | D. | H2O2 |
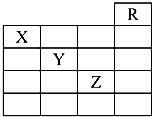 如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐
②Y、Z的气态氢化物水溶液的均显酸性
③Z的单质在常温下是液体
④Z所在的周期中含有32种元素.
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu═2Fe2++Cu2+ |
| A. | Fe304 | B. | FeCl3 | C. | FeCl2 | D. | FeS |