题目内容
4.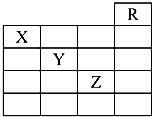 如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐
②Y、Z的气态氢化物水溶液的均显酸性
③Z的单质在常温下是液体
④Z所在的周期中含有32种元素.
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
分析 如图是元素周期表的一部分,则R为He、X为氮元素、Y为硫元素、Z为Br元素,
①氨气与硫酸反应可以生成硫酸铵;
②氨气的水溶液显碱性;
③常温下,溴为液体;
④Br所在的周期中含有18种元素.
解答 解:如图是元素周期表的一部分,则R为He、X为氮元素、Y为硫元素、Z为Br元素,
①氨气与硫酸反应可以生成硫酸铵,硫酸铵为盐,故正确;
②氨水溶液显碱性,HBr溶液显酸性,故错误;
③溴常温下为液体,故正确;
④Br处于第四周期,所在的周期中含有18种元素,故错误,
故选C.
点评 本题考查位置、结构、性质及用途,为高频考点,把握元素的位置、元素及化合物的性质为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.有关如图所示原电池的叙述正确的是( )
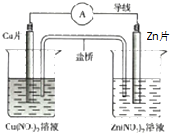

| A. | 盐桥中阴离子向正极移动 | |
| B. | 正极的电极反应是:Zn2++2e-═Zn | |
| C. | Zn片上发生氧化反应 | |
| D. | 用该电池电解水,析出3.2gCu时生成1.12LO2(标况下) |
12.(1)写出下列反应的化学方程式
①过氧化钠与二氧化碳:2Na2O2+2CO2═2Na2CO3+O2
②碳与浓硫酸:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(2)下列两组溶液分别选用一种试剂鉴别,写出试剂的化学式.
①NaCl Na2CO3 Na2SiO3 Na2SO3 试剂:盐酸
②Na2SO4、Al2(SO4)3、FeCl2、(NH4)2SO4试剂:氢氧化钡溶液
(3)除去表内各物质中含有的少量杂质,写出除杂试剂,并填写分离方法和反应的离子方程式.
(4)已知双氧水可使酸性KMnO4溶液褪色,同时放出氧气,完成并配平该反应的离子方程式:
2MnO4-+5H2O2+6H+2Mn2++5O2↑+8H2O.
①过氧化钠与二氧化碳:2Na2O2+2CO2═2Na2CO3+O2
②碳与浓硫酸:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(2)下列两组溶液分别选用一种试剂鉴别,写出试剂的化学式.
①NaCl Na2CO3 Na2SiO3 Na2SO3 试剂:盐酸
②Na2SO4、Al2(SO4)3、FeCl2、(NH4)2SO4试剂:氢氧化钡溶液
(3)除去表内各物质中含有的少量杂质,写出除杂试剂,并填写分离方法和反应的离子方程式.
| 序号 | 物质 | 杂质 | 所加试剂 | 分离方法 | 离子方程式 |
| 1. | NO | NO2 | |||
| 2. | Fe粉 | Al粉 |
2MnO4-+5H2O2+6H+2Mn2++5O2↑+8H2O.
13.部分共价键的键长和键能的数据如表,则以下推理肯定错误的是( )
| 共价键 | C-C | C=C | C≡C |
| 键长(nm) | 0.154 | 0.134 | 0.120 |
| 键能(kJ/mol) | 347 | 612 | 838 |
| A. | 0.154 nm>苯中碳碳键键长>0.134nm | |
| B. | C=O键键能>C-O键键能 | |
| C. | 乙烯的沸点高于乙烷 | |
| D. | 烯烃比炔烃更易与溴加成 |
 .
.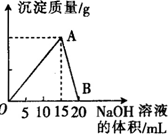 向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示: