题目内容
7.(1)111g CaCl2中含1mol Ca2+,2mol Cl-,总离子数3NA.(2)3mol H2O中含有的氧原子数与1.5mol CO2中含有的氧原子数相同
(3)已知R2+核内共有N个中子,R原子的质量数为A,其电子数为A-N+2,m g R2+中所含有的电子的物质的量为$\frac{m(A-N+2)}{A}$mol.
分析 (1)根据m=nM结合物质的微粒构成情况进行计算;
(2)1.5mol CO2中含有的氧原子物质的量是3mol,微粒的数目之比等于微粒的物质的量之比;
(3)R原子的质量数为A,则其摩尔质量为Ag/mol,根据n=$\frac{m}{M}$计算原子的物质的量;质量数=质子数+中子数,再由阴离子R2-核外有N个中子,则质子数为A-N,阴离子中:质子数+所带电荷数=核外电子数,该离子的核外电子总数为A-N+2,以此解答该题.
解答 解:(1)111g CaCl2的物质的量n=$\frac{111g}{111g/mol}$=1mol,含有钙离子的物质的量是1mol,氯离子的物质的量是2mol,总离子数是3NA,故答案为:1;2;3NA;
(2)1.5mol CO2中含有的氧原子物质的量是3mol,微粒的数目之比等于微粒的物质的量之比,所以和3molH2O中含有的氧原子数,故答案为:3;
(3)R原子的质量数为A,则其摩尔质量为Ag/mol,根据n=$\frac{m}{M}$计算原子的物质的量;质量数=质子数+中子数,再由阴离子R2-核外有N个中子,则质子数为A-N,阴离子中:质子数+所带电荷数=核外电子数,该离子的核外电子总数为A-N+2,所以mg Rn-电子的物质的量为:$\frac{m}{A}$mol×(A-N+2)=$\frac{m(A-N+2)}{A}$mol,故答案为:A-N+2;$\frac{m(A-N+2)}{A}$mol.
点评 本题考查学生利用原子构成的简单计算,题目难度不大,明确原子的物质的量的计算是解答本题的关键,注意电子的质量可忽略,质量数近似等于相对原子质量.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
2.下列有关物质的性质和应用相对应的是( )
| A. | 纯碱溶液显碱性,可用热的纯碱溶液除去金属表面的油污 | |
| B. | 明矾溶于水可形成氢氧化铝胶体,可用于自来水的杀菌消毒 | |
| C. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| D. | 氢氧化铁的溶解度比氢氧化铜的小得多,可向硫酸铜溶液中加入氢氧化铁除去混有的Cu2+ |
12.(1)写出下列反应的化学方程式
①过氧化钠与二氧化碳:2Na2O2+2CO2═2Na2CO3+O2
②碳与浓硫酸:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(2)下列两组溶液分别选用一种试剂鉴别,写出试剂的化学式.
①NaCl Na2CO3 Na2SiO3 Na2SO3 试剂:盐酸
②Na2SO4、Al2(SO4)3、FeCl2、(NH4)2SO4试剂:氢氧化钡溶液
(3)除去表内各物质中含有的少量杂质,写出除杂试剂,并填写分离方法和反应的离子方程式.
(4)已知双氧水可使酸性KMnO4溶液褪色,同时放出氧气,完成并配平该反应的离子方程式:
2MnO4-+5H2O2+6H+2Mn2++5O2↑+8H2O.
①过氧化钠与二氧化碳:2Na2O2+2CO2═2Na2CO3+O2
②碳与浓硫酸:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(2)下列两组溶液分别选用一种试剂鉴别,写出试剂的化学式.
①NaCl Na2CO3 Na2SiO3 Na2SO3 试剂:盐酸
②Na2SO4、Al2(SO4)3、FeCl2、(NH4)2SO4试剂:氢氧化钡溶液
(3)除去表内各物质中含有的少量杂质,写出除杂试剂,并填写分离方法和反应的离子方程式.
| 序号 | 物质 | 杂质 | 所加试剂 | 分离方法 | 离子方程式 |
| 1. | NO | NO2 | |||
| 2. | Fe粉 | Al粉 |
2MnO4-+5H2O2+6H+2Mn2++5O2↑+8H2O.
17.下列说法正确的是( )
| A. | 碱性氧化物都是金属氧化物 | |
| B. | 凡是酸性氧化物都能和水反应生成相应的酸 | |
| C. | 单质含有一种元素,有一种元素形成的物质就是单质 | |
| D. | 凡在水中电离出H+的物质就是酸 |
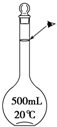 实验室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步骤: 图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,回答问题:
图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,回答问题: .
.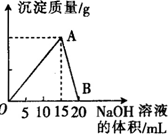 向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示: