题目内容
1.下列离子方程式书写正确的是( )| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu═2Fe2++Cu2+ |
分析 A.电子不守恒;
B.漏写生成氢氧化铜的离子反应;
C.反应生成氢氧化铝和氯化铵;
D.电子、电荷不守恒.
解答 解:A.钠与水反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.硫酸铜溶液与氢氧化钡溶液反应的离子反应为Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓,故B错误;
C.AlCl3溶液中加入过量氨水的离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故C错误;
D.用FeCl3溶液腐蚀印刷电路板的离子反应为2Fe3++Cu═2Fe2++Cu2+,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
11.下列各组物质中,互为同分异构体的是( )
| A. | O2与O3 | B. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C | ||
| C. | CH2Cl2与CHCl3 | D. | CH3-CH2-CH2-CH3与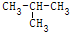 |
12.(1)写出下列反应的化学方程式
①过氧化钠与二氧化碳:2Na2O2+2CO2═2Na2CO3+O2
②碳与浓硫酸:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(2)下列两组溶液分别选用一种试剂鉴别,写出试剂的化学式.
①NaCl Na2CO3 Na2SiO3 Na2SO3 试剂:盐酸
②Na2SO4、Al2(SO4)3、FeCl2、(NH4)2SO4试剂:氢氧化钡溶液
(3)除去表内各物质中含有的少量杂质,写出除杂试剂,并填写分离方法和反应的离子方程式.
(4)已知双氧水可使酸性KMnO4溶液褪色,同时放出氧气,完成并配平该反应的离子方程式:
2MnO4-+5H2O2+6H+2Mn2++5O2↑+8H2O.
①过氧化钠与二氧化碳:2Na2O2+2CO2═2Na2CO3+O2
②碳与浓硫酸:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(2)下列两组溶液分别选用一种试剂鉴别,写出试剂的化学式.
①NaCl Na2CO3 Na2SiO3 Na2SO3 试剂:盐酸
②Na2SO4、Al2(SO4)3、FeCl2、(NH4)2SO4试剂:氢氧化钡溶液
(3)除去表内各物质中含有的少量杂质,写出除杂试剂,并填写分离方法和反应的离子方程式.
| 序号 | 物质 | 杂质 | 所加试剂 | 分离方法 | 离子方程式 |
| 1. | NO | NO2 | |||
| 2. | Fe粉 | Al粉 |
2MnO4-+5H2O2+6H+2Mn2++5O2↑+8H2O.
13.部分共价键的键长和键能的数据如表,则以下推理肯定错误的是( )
| 共价键 | C-C | C=C | C≡C |
| 键长(nm) | 0.154 | 0.134 | 0.120 |
| 键能(kJ/mol) | 347 | 612 | 838 |
| A. | 0.154 nm>苯中碳碳键键长>0.134nm | |
| B. | C=O键键能>C-O键键能 | |
| C. | 乙烯的沸点高于乙烷 | |
| D. | 烯烃比炔烃更易与溴加成 |
10.下列各组物质反应后,溶液的导电性比反应前明显增加的是(忽略溶液体积变化)( )
| A. | 向0.1mol/L NaOH溶液滴加醋酸 | |
| B. | 向氢硫酸饱和溶液中通入氯气 | |
| C. | 向氯化铜溶液中加入适量氢氧化钡溶液 | |
| D. | 向硝酸银溶液通入氯化氢气体 |
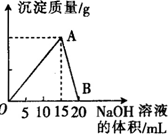 向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示: