题目内容
8.现有如下两个反应:(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池(用编号回答)(A)不能,(B)可以.
(2)如果不能,说明其原因(A)的反应为非氧化还原反应,没有电子转移.
(3)如果可以,则写出正极电极反应式Fe3++e-=Fe2+.
分析 能自发进行的氧化还原反应可以设计成原电池,据此回答.
解答 解:能自发进行的氧化还原反应可以设计成原电池,
(1)A为非氧化还原反应,B为氧化还原反应,故(A)不能,(B)可以,故答案为:(A)不能,(B)可以;
(2)(A)的反应为非氧化还原反应,没有电子转移,故答案为:(A)的反应为非氧化还原反应,没有电子转移;
(3)(B)可以,正极得电子发生还原反应,故答案为:Fe3++e-=Fe2+.
点评 本题考查原电池原理,能自发进行的氧化还原反应才能设计成原电池,属于基础题,比较容易得分.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列化学用语表述正确的是( )
| A. | ${\;}_{8}^{16}$O2-的结构示意图: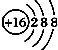 | |
| B. | NH4Br的电子式: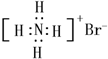 | |
| C. | CCl4的结构式 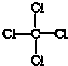 | |
| D. | 氧元素基态原子的电子排布式:1s22s12p3 |
16.按要求回答下列问题.
(1)A元素的负一价离子的电子层结构与氩相同,它在元素周期表中的位置为第三周期第VIIA族
(2)B元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素名称为碳或氧
(3)D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,D的最外层电子排布式
为4s1
(4)X元素的原子最外层电子排布式为nsnnpn+1,Y元素的某同位素原子无中子.X和Y形成的最简单化合物的结构式为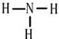
(5)M元素的正三价离子的3d能级为半充满,M基态原子的电子排布式为1s22s22p63s23p63d64s2
(6)如表是N逐级失去电子的电离能.
则元素N的常见价态是+3价.
(1)A元素的负一价离子的电子层结构与氩相同,它在元素周期表中的位置为第三周期第VIIA族
(2)B元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素名称为碳或氧
(3)D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,D的最外层电子排布式
为4s1
(4)X元素的原子最外层电子排布式为nsnnpn+1,Y元素的某同位素原子无中子.X和Y形成的最简单化合物的结构式为
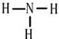
(5)M元素的正三价离子的3d能级为半充满,M基态原子的电子排布式为1s22s22p63s23p63d64s2
(6)如表是N逐级失去电子的电离能.
| I1 | I2 | I3 | I4 | I5 | I6 | |
| In | 578 | 1817 | 2745 | 11578 | 14831 | 18378 |
3.下列有关第ⅦA族元素的单质和化合物性质说法正确的是( )
| A. | 还原性:HF>HCl>HBr>HI | |
| B. | 稳定性:HF<HCl<HBr<HI | |
| C. | 从F2到I2,颜色逐渐加深 | |
| D. | 与氢气化合由易到难:I2>Br2>Cl2>F2 |
13.下列说法错误的是( )
| A. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| B. | 煤炭燃烧前经过脱硫处理可减少酸雨的产生 | |
| C. | 燃料电池是一种高效、友好的发电装置,可将化学能完全转化为电能 | |
| D. | 太阳能的利用,一般是将太阳辐射能先转化为热能、电能或化学能,再加以利用 |
20.下列指定溶液中一定能大量共存的离子组是( )
| A. | pH=1的溶液中:NH4+、Na+、Fe3+、SO42- | |
| B. | 含有大量AlO2-的溶液中:Na+、K+、HCO3-、NO3- | |
| C. | 中性溶液中:K+、Fe3+、Cl-、SO42- | |
| D. | Na2S溶液中:SO42-、K+、Cu2+、Cl- |
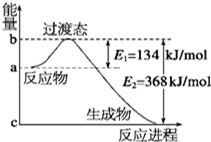 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)CO2(g)+NO(g)△H=-234kJ/mol.
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)CO2(g)+NO(g)△H=-234kJ/mol.