题目内容
19.下列化学用语表述正确的是( )| A. | ${\;}_{8}^{16}$O2-的结构示意图: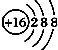 | |
| B. | NH4Br的电子式: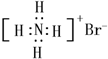 | |
| C. | CCl4的结构式 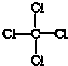 | |
| D. | 氧元素基态原子的电子排布式:1s22s12p3 |
分析 A.氧离子的核电荷数为8,带有2个单位的负电荷;
B.溴化铵的电子式中,铵根离子中氮原子和氢原子的最外层电子数应该标出;
C.有机物的结构式:用短线表示出共用电子对;
D.处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、保里不相容原理和洪特规则.
解答 解:A.氧离子的核电荷数为8,带有2个单位的负电荷,其核外电子数为10,其结构示意图为 ,故A错误;
,故A错误;
B.溴化铵为离子化合物,阳离子为原子团,电子式中需要标出N、H原子的最外层电子数,溴化铵的电子式为: ,故B错误;
,故B错误;
C.C与Cl形成四对共价键,四氯化碳的结构式为: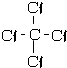 ,故C正确;
,故C正确;
D.O元素为8号元素,原子核外有8个电子,所以核外电子排布式为:1s22s22p4,故D错误.
故选C.
点评 本题考查了化学用语,难度不大,涉及结构示意图、电子式、结构式以及电子排布式等知识,注意基态原子的电子排布式的书写,根据核外电子排布规律来写,为易错点.

练习册系列答案
相关题目
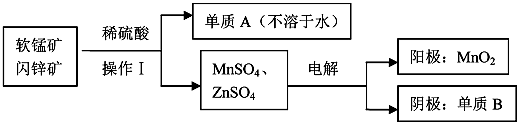
9.硫酸工业生产应考虑综合经济效益问题,根据下面工业生产硫酸的工艺流程图回答有关问题:
(1)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO2在沸腾炉中化合而成),CuFeS2是黄铁矿的另一成分,写出煅烧CuFeS2的化学方程式为4CuFeS2+13O2$\frac{\underline{\;煅烧\;}}{\;}$ 4CuO+2Fe2O3+8SO2.
(2)流程图中设备A是接触室(填设备名称),其中该设备上部迅婚使用的气体为SO2和O2.
(3)吸收塔采用98.3%浓硫酸吸收SO2的原因是可以防止形成酸雾,使三氧化硫吸收完全.
(4)根据工艺流程图及环保角度判断下列说法正确的是ABDE(填序号)
A.为使黄铁矿充分燃烧,需将其粉碎
B.沸腾炉中排出的炉渣可供炼铁
C.使用催化剂可提高SO2的反应速率和转化率
D.尾气中SO2可用NaOH浓溶液来吸收
E.硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
(5)沸腾炉排出的炉渣中的硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
请用平衡移动原理解释上表中CuSO4的质量分数随温度升高而降低的原因SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少).
(6)某硫酸厂为测定设备A中所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后(不考虑氧气的影响),用浓度为0.02mol/L的K2Cr2O7标准溶液滴定至中点,消耗K2Cr2O7溶液25.00mL,则接触室所得气体中SO2的体积分数为12.00%.

(1)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO2在沸腾炉中化合而成),CuFeS2是黄铁矿的另一成分,写出煅烧CuFeS2的化学方程式为4CuFeS2+13O2$\frac{\underline{\;煅烧\;}}{\;}$ 4CuO+2Fe2O3+8SO2.
(2)流程图中设备A是接触室(填设备名称),其中该设备上部迅婚使用的气体为SO2和O2.
(3)吸收塔采用98.3%浓硫酸吸收SO2的原因是可以防止形成酸雾,使三氧化硫吸收完全.
(4)根据工艺流程图及环保角度判断下列说法正确的是ABDE(填序号)
A.为使黄铁矿充分燃烧,需将其粉碎
B.沸腾炉中排出的炉渣可供炼铁
C.使用催化剂可提高SO2的反应速率和转化率
D.尾气中SO2可用NaOH浓溶液来吸收
E.硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
(5)沸腾炉排出的炉渣中的硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(6)某硫酸厂为测定设备A中所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后(不考虑氧气的影响),用浓度为0.02mol/L的K2Cr2O7标准溶液滴定至中点,消耗K2Cr2O7溶液25.00mL,则接触室所得气体中SO2的体积分数为12.00%.
7.NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 密闭容器中1mol N2与3mol H2充分反应,产物的分子数为2NA | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+个数为2NA | |
| C. | 在标准状况下,22.4L溴所含的原子数目为2NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
14.废弃物资源化对于建设资源节约型社会具有重要的意义.研究小组测某矿灰的成分,其主要成分为Fe,可能还含有KCl、FeO、Fe2O3、MgO、SiO2、MnO2中的若干种.为了确认其成分,某同学依次进行了以下实验:
①将过量的稀盐酸加入矿灰中,充分反应后过滤得到溶液甲和固体乙
②取少量溶液甲滴加AgNO3溶液,生成白色沉淀
③取少量溶液甲分成两等份,向其中一份滴加酸性高锰酸钾溶液,高锰酸钾溶液褪色;向另一份滴加KSCN溶液,溶液变成血红色
④取少量溶液甲加入过量NaOH溶液,并置于空气中.充分反应后经过滤、洗涤、灼烧得到1.60g固体丙,将固体丙置于氢气流中加热充分反应后得到1.12g固体丁
根据以上实验现象或数据,该同学得出的结论正确的是( )
①将过量的稀盐酸加入矿灰中,充分反应后过滤得到溶液甲和固体乙
②取少量溶液甲滴加AgNO3溶液,生成白色沉淀
③取少量溶液甲分成两等份,向其中一份滴加酸性高锰酸钾溶液,高锰酸钾溶液褪色;向另一份滴加KSCN溶液,溶液变成血红色
④取少量溶液甲加入过量NaOH溶液,并置于空气中.充分反应后经过滤、洗涤、灼烧得到1.60g固体丙,将固体丙置于氢气流中加热充分反应后得到1.12g固体丁
根据以上实验现象或数据,该同学得出的结论正确的是( )
| A. | 根据①可推出矿灰中一定含有SiO2 | |
| B. | 根据②可推出矿灰中一定含有KCl | |
| C. | 根据③可推出矿灰中一定含有FeO和Fe2O3 | |
| D. | 根据④可推出固体丙中一定不含MgO |
4.已知W、X、Y、Z是短周期元素,aW3+、bX+、cY2-、dZ-四种离子具有相同的电子层结构,下列关系正确的是( )
| A. | 最外层电子数:Y>Z | |
| B. | 核电荷数:a>b | |
| C. | 稳定性:H2Y>HZ | |
| D. | X单质一定能从W的盐溶液中置换出W单质 |
11.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素.下列说法正确的是( )
| A. | Y2分子中,σ键和π键数目之比为2:1 | |
| B. | Z单质与W单质发生反应,产物只有一种 | |
| C. | 元素X、Z形成的化合物中仅含极性共价键 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |

 $→_{Zn/H_{2}O}^{O_{3}}$
$→_{Zn/H_{2}O}^{O_{3}}$ +
+
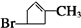 、E
、E .
.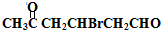 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$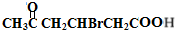 +Cu2O↓+2H2O.
+Cu2O↓+2H2O. .
.