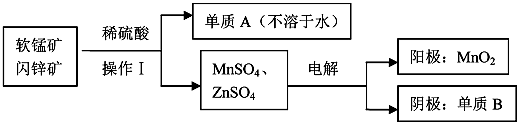
题目内容
20.下列指定溶液中一定能大量共存的离子组是( )| A. | pH=1的溶液中:NH4+、Na+、Fe3+、SO42- | |
| B. | 含有大量AlO2-的溶液中:Na+、K+、HCO3-、NO3- | |
| C. | 中性溶液中:K+、Fe3+、Cl-、SO42- | |
| D. | Na2S溶液中:SO42-、K+、Cu2+、Cl- |
分析 A.pH=1的溶液,显酸性,该组离子之间不反应;
B.AlO2-促进HCO3-的电离;
C.Fe3+在pH为4.4左右沉淀完全;
D.离子之间结合生成沉淀.
解答 解:A.pH=1的溶液,显酸性,该组离子之间不反应,可大量共存,故A正确;
B.AlO2-促进HCO3-的电离,不能大量共存,故B错误;
C.Fe3+在pH为4.4左右沉淀完全,则中性溶液中不能大量存在Fe3+,故C错误;
D.Cu2+、S2-结合生成沉淀,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
11.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素.下列说法正确的是( )
| A. | Y2分子中,σ键和π键数目之比为2:1 | |
| B. | Z单质与W单质发生反应,产物只有一种 | |
| C. | 元素X、Z形成的化合物中仅含极性共价键 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
15.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 金属铝的冶炼:2AlCl3(熔融)$\frac{\underline{\;通电\;}}{\;}$2Al+3Cl2↑ | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 碱性氢氧燃料电池的正极反应为:O2+4e-+2H2O═4OH- |
5.只用一种试剂就能将甲苯、环己烯、四氯化碳、碘化钾溶液区分开来,该试剂可以是( )
| A. | 溴化钾溶液 | B. | 溴水 | C. | 高锰酸钾溶液 | D. | 硝酸银溶液 |
12.下列变化过程中,一定不存在化学能与热能相互转化的是( )
| A. | 原电池反应 | B. | 干冰升华 | C. | 粮食酿酒 | D. | 节日放鞭炮焰火 |
10.下列关于物质用途的叙述中正确的是( )
| A. | 一种物质被氧化,必有另一种物质被还原 | |
| B. | CO2的水溶液可以导电,所以CO2是电解质 | |
| C. | Na2O2可用作呼吸面具中的供氧剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |

 $→_{Zn/H_{2}O}^{O_{3}}$
$→_{Zn/H_{2}O}^{O_{3}}$ +
+
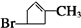 、E
、E .
.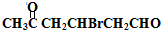 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$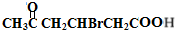 +Cu2O↓+2H2O.
+Cu2O↓+2H2O. .
.