题目内容
18.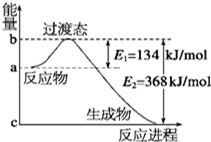 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)CO2(g)+NO(g)△H=-234kJ/mol.
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)CO2(g)+NO(g)△H=-234kJ/mol.(2)氨是最重要的氮肥,是产量最大的化工产品之一.其合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,在定容密闭容器中,使2mol N2和6mol H2混合发生反应,平衡时N2转化率为20%:
①当反应达到平衡时,N2和H2的浓度比是1:3,N2和H2的转化率比是1:1,反应共放热36.96kJ.
②升高平衡体系的温度,密度不变.(填“变大”、“变小”或“不变”)
③当达到平衡时,充入氩气,平衡将不(填“正向”、“逆向”或“不”)移动.
分析 (1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)①加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,氮气和氢气的浓度之比永始终是1:3,转化率之比1:1;根据热化学方程式根据焓变与系数成正比计算放出的热量;
②平均相对分子质量=$\frac{气体质量总和}{气体物质的量总和}$,ρ=$\frac{m}{V}$;
③定容密闭容器中,充入氩气,反应物生成物浓度不变,平衡不移动.
解答 解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
(2)①加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,用氮气和氢气表示的速率正比等于化学计量数之比,所以氮气和氢气的浓度之比永始终是1:3,转化率之比1:1,
设反应共放热xKJ,则有
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
1 92.4
2×20% x
所以解得x=92.4×2×20%=36.96KJ
故答案为:1:3;1:1;36.96;
②升温,平衡逆向移动,气体物质的量增大,质量不变,气体的平均相对分子质量=$\frac{气体质量总和}{气体物质的量总和}$,所以,混合气体的平均相对分子质量减小;
因容器体积没变,气体质量不变,所以密度不变,
故答案为:变小;不变;
③定容密闭容器中,充入氩气,反应物生成物浓度不变,平衡不移动,
故答案为:不.
点评 本题考查了热化学方程式的书写、反应速率与化学计量数的关系、气体的平均相对分子质量、密度、化学平衡的移动,题目难度不大.

| A. | 检验淀粉溶液可以用碘化钾溶液 | |
| B. | 油脂在碱性条件下水解可以得到甘油和高级脂肪酸 | |
| C. | 向蛋白质溶液中加入饱和氯化铜溶液有固体析出,加入一定量水后固体不会溶解 | |
| D. | 乙烯使溴水褪色和使酸性高锰酸钾溶液褪色的原理是一样的 |
| A. | 一种物质被氧化,必有另一种物质被还原 | |
| B. | CO2的水溶液可以导电,所以CO2是电解质 | |
| C. | Na2O2可用作呼吸面具中的供氧剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
| A. | Cl2 | B. | KCl | C. | Br2 | D. | KBr |
| A. | 若该反应的△H<0,升高温度,平衡常数K减小 | |
| B. | 若增大X的浓度,则物质Y的转化率减小 | |
| C. | 以X浓度变化表示的反应速率为$\frac{1}{8}$ mol/(L•s) | |
| D. | 12 s后将容器体积扩大为10 L,Z的平衡浓度变为原来的$\frac{1}{5}$ |

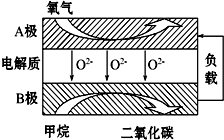 以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图.回答下列问题:
以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图.回答下列问题: