题目内容
19.将4mol A气体和2mol B气体在2L的密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)?2C(g),若经过2秒后测得C的浓度为0.6mol/L.求:(1)2s内用B表示的反应速率大小;
(2)2s时A的物质的量浓度;
(3)2s时B的物质的量大小;
(4)最终C的浓度不能(填“能”或“不能”)达到2mol/L.
分析 若经过2秒后测得C的浓度为0.6mol/L.则
2A(g)+B(g)?2C(g)
开始 2 1 0
转化 0.6 0.3 0.6
2s 1.4 0.7 0.6
(1)结合v=$\frac{△c}{△t}$计算;
(2)2s时A的物质的量浓度为A的起始浓度-A的转化浓度;
(3)结合n=cV计算;
(4)该反应为可逆反应,不能完全转化.
解答 解:若经过2秒后测得C的浓度为0.6mol/L.则
2A(g)+B(g)?2C(g)
开始 2 1 0
转化 0.6 0.3 0.6
2s 1.4 0.7 0.6
(1)2s内用B表示的反应速率为$\frac{0.3mol/L}{2s}$=0.15mol/(L.s),
答:2s内用B表示的反应速率为0.15mol/(L.s);
(2)由上述三段法可知,2s时A的物质的量浓度为1.4mol/L,
答:2s时A的物质的量浓度为1.4mol/L;
(3)2s时B的物质的量为0.7mol/L×2L=1.4mol,
答:2s时B的物质的量为1.4mol;
(4)该反应为可逆反应,不能完全转化,A的起始浓度为2mol/L,则最终C的浓度不能达到2mol/L,
故答案为:不能.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、速率及浓度的计算为解答的关键,侧重分析与计算能力的考查,注意可逆反应的特征,题目难度不大.

练习册系列答案
相关题目
6.下列指定反应的离子方程式正确的是( )
| A. | 苯酚中加入Na2CO3溶液中:CO32-+C6H5OH→C6H5O-+HCO3- | |
| B. | 0.3molFeI2与0.4molCl2在溶液中反应:6Fe2++10I-+8Cl2═6Fe3++16Cl-+5I2 | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应后溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
7.已知断裂1mol H2(g)中的H-H键需要吸收436.4KJ的能量,断裂1mol O2(g)中的共价键需要吸收498KJ的能量,生成H2O(g)中的1mol H-O键能放出462.8KJ的能量.下列说法正确的是( )
| A. | 断裂1 mol H2O中的化学键需要吸收925.6 KJ的能量 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H=-480.4 KJ•mol-1 | |
| C. | 2H2O(l)═2H2(g)+O2(g)△H=471.6 KJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-240.2KJ•mol-1 |
14.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2(g)$\stackrel{高温}{?}$W(s)+3H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应吸热(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O.
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应吸热(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
9.分类法在化学科学中起着非常重要的作用,下列各组物质中,在物质分类型,前者从属于后者的一组是( )
| A. | 金属,化合物 | B. | 金属氧化物,碱性氧化物 | ||
| C. | 泥沙,胶体 | D. | 单质,纯净物 |
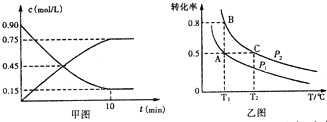
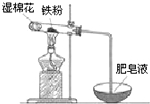 铝和铁是日常生活中用途广泛的金属.
铝和铁是日常生活中用途广泛的金属. 实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)
实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)