题目内容
7.硫及其化合物有广泛应用.(1)硫酸生产过程中涉及以下反应.已知25℃、l0l kPa时:
①2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ/mol
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ/mol
则SO2催化氧化反应中,每生成2mol SO3(g)的△H=-197kJ•mol-1.
(2)对于SO2催化氧化反应:2SO2(g)+O2(g)?2SO3(g).
①甲图是SO2催化氧化反应时SO2(g)和SO3(g)的浓度随时间的变化情况.反应从开始到达到平衡时,用O2表示的平均反应速率为0.0375mol/(L.min).
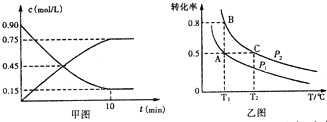
②在一容积可变的密闭容器中充入20mol SO2(g)和l0mol O2(g),O2的平衡转化率随温度(T)、压强(P)的变化如乙图所示.则P1与P2的大小关系是P1< P2(填>、=或<);A、B、C三点的平衡常数大小关系是KA=KB>KC(用KA、KB、KC和>、=、<表示).
(3)工业生成硫酸过程中,通常用氨水吸收尾气.
①如果相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为SO2+NH3+H2O=NH4++HSO3-,得溶液中c(H+)-c(OH-)=CD(填序号).
A.c(SO32-)-c(H2SO3) B.c(HSO3-)+c(SO32-)-c(NH4+)
C.c(HSO3-)+2c(SO32-)-c(NH4+) D.c(SO32-)+c(NH3H2O)-c(H2SO3)
②工业上用足量氨水吸收硫酸工业废气.吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性,则吸收Cl2后的溶液中一定存在的阴离子有OH-和SO42-、Cl-.
分析 (1)①2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
根据盖斯定律,①-②×2可得:2SO2(g)+O2(g)═2SO3(g);
(2)①SO2为反应物,随反应进行浓度减小,而SO3为生成物,随反应进行浓度增大,由v=$\frac{△c}{△t}$计算v(SO3),再利用速率之比等于化学计量数之比计算v(O2);
②正反应为气体体积减小的反应,增大压强平衡正向移动,O2的平衡转化率增大;
平衡常数只受温度影响,与压强无关,温度相同,则平衡常数相等,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
(3)①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应:SO2+NH3+H2O=NH4HSO3;
根据电荷守恒c(H+)+c(NH4+)=c(OH-)+c(HSO3-)+2c(SO32-),由微粒守恒可知c(NH3•H2O)+c(NH4+)=c(H2SO3)+c(HSO3-)+c(SO32-);
②吸收SO2后的碱性溶液,含亚硫酸钠、NaOH,吸收Cl2后的溶液仍呈强碱性,溶质为硫酸钠、NaCl、NaOH.
解答 解:(1)由①2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
根据盖斯定律,①-②×2可得:2SO2(g)+O2(g)═2SO3(g)△H=-197kJ•mol-1,
故答案为:-197;
(2)①SO2为反应物,随反应进行浓度减小,而SO3为生成物,随反应进行浓度增大,由图可知△c(SO3)=0.75mol/L,则v(SO3)=$\frac{0.75mol/L}{10min}$=0.075mol/(L.min),速率之比等于化学计量数之比,则v(O2)=$\frac{1}{2}$v(SO3)=0.0375mol/(L.min),
故答案为:0.0375mol/(L.min);
②由图可知压强P2时氧气转化率更大,正反应为气体体积减小的反应,增大压强平衡正向移动,O2的平衡转化率增大,故氧气P1<P2;
平衡常数只受温度影响,与压强无关,A、B温度相同,则平衡常数相等,C点温度最高,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故平衡常数KA=KB>KC,
故答案为:<;KA=KB>KC;
(3)①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应SO2+NH3+H2O=NH4HSO3,反应离子方程式为SO2+NH3+H2O=NH4++HSO3-;
根据电荷守恒c(H+)+c(NH4+)=c(OH-)+c(HSO3-)+2c(SO32-),所得溶液中c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+),
由微粒守恒可知c(NH3•H2O)+c(NH4+)=c(H2SO3)+c(HSO3-)+c(SO32-),则所得溶液中c(H+)-c(OH-)=c(SO32-)+c(NH3•H2O)-c(H2SO3),
故答案为:SO2+NH3+H2O=NH4++HSO3-;CD;
②吸收SO2后的碱性溶液,含亚硫酸钠、NaOH,吸收Cl2后的溶液仍呈强碱性,溶质为硫酸钠、NaCl、NaOH,则吸收Cl2后的溶液中一定存在的阴离子有OH-和SO42-、Cl-,故答案为:SO42-、Cl-.
点评 本题考查化学平衡的计算,为高频考点,把握图象分析、浓度变化、盖斯定律应用、离子浓度关系为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案①在敞口容器中将金属钠投入到FeC12溶液中
②向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液
③向饱和Na2CO3溶液中通入过量CO2
④向NaAlO2溶液中通入过量CO2.
| A. | ①③④ | B. | 只有①④ | C. | 只有②③ | D. | 只有③④ |
| A. | 0.1 mol/L氨水中:c(NH4+)+c(H+)═c(OH-) | |
| B. | 0.1 mol/L的NH4Cl溶液中:c(NH4+)═c(Cl-) | |
| C. | 同为0.1 mol/L的硫酸和氨水等体积混合后:c(NH4+)+c(NH3•H2O)═2c(SO42-) | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-)=c(H+) |
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 16种 |
| A. | HF+H2O?H3O++F- | |
| B. | NaHCO3=Na++HCO3-,HCO3-?H++CO32- | |
| C. | Ag2S(s)?2Ag+(aq)+S2-(aq) | |
| D. | S2-+2H2O?H2S+2OH- |

 氯及其化合物在生活和生产中应用广泛.
氯及其化合物在生活和生产中应用广泛.