题目内容
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为0.1NA |
| B、0.1mol苯中含有双键的数目为0.3NA |
| C、标准状况下,22.4L乙醇中含有分子的数目为NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.过氧化钠和硫化钠的摩尔质量都是78g/mol,过氧化钠中阴离子为过氧根离子;
B.苯中的碳碳键为一种介于单键和双键之间的独特键,不存在碳碳双键;
C.标准状况下,乙醇的状态不是气体,不能使用标况下的气体摩尔体积计算乙醇的物质的量;
D.过氧化钠中氧元素的化合价为-1价,生成0.1mol氧气转移了0.2mol电子.
B.苯中的碳碳键为一种介于单键和双键之间的独特键,不存在碳碳双键;
C.标准状况下,乙醇的状态不是气体,不能使用标况下的气体摩尔体积计算乙醇的物质的量;
D.过氧化钠中氧元素的化合价为-1价,生成0.1mol氧气转移了0.2mol电子.
解答:
解:A.7.8g硫化钠和过氧化钠混合物的物质的量为0.1mol,由于过氧化钠中阴离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数为0.1NA,故A正确;
B.苯分子中的碳碳键为一种独特键,不存在碳碳双键,故B错误;
C.标况下乙醇不是气体,不能使用标况下的气体摩尔体积计算22.4L乙醇的物质的量,故C错误;
D.过氧化钠与水反应生成0.1mol氧气,转移了0.2mol电子,转移电子的数目为0.2NA,故D错误;
故选A.
B.苯分子中的碳碳键为一种独特键,不存在碳碳双键,故B错误;
C.标况下乙醇不是气体,不能使用标况下的气体摩尔体积计算22.4L乙醇的物质的量,故C错误;
D.过氧化钠与水反应生成0.1mol氧气,转移了0.2mol电子,转移电子的数目为0.2NA,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下乙醇、水、三氧化硫、氟化氢等物质的状态,选项D为易错点,注意过氧化钠中氧元素的化合价为-1价.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
下列反应的现象描述与离子方程式都正确的是( )
| A、金属镁与稀盐酸反应:有气泡逸出:Mg+2H++2Cl-═MgCl2+H2↑ |
| B、NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
| C、碳酸钠溶液与盐酸反应:有气泡逸出:Na2CO3+2H+═2Na++CO2↑+H2O |
| D、氯化钡溶液与稀硫酸反应:有白色沉淀生成:Ba2++SO42-═BaSO4↓ |
下列有关表述正确的是( )
A、次氯酸的电子式: |
B、N原子的电子排布图: |
| C、硫原子的价电子排布式:3s23p4 |
| D、氯化钠的分子式:NaCl |
如果用NA表示阿伏德罗常数的数值,下列叙述正确的是( )
| A、标准状况下,22.4LH2O含有的分子数为 NA |
| B、18 g水中所含的电子数为10NA |
| C、在含1mol氢氧化铁的胶体中,胶粒数目为NA |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,0.1NA个HCl分子的体积为2.24L |
| B、标准状况下,22.4L 氖气含有2NA 个原子 |
| C、1L 0.2mol/L 硫酸铁溶液中含有的SO42- 离子数目为0.2 NA |
| D、1 mol氖中含有的电子数为10NA |
用聚光手电筒照射下列分散系,可观察到丁达尔效应的是( )
| A、KOH溶液 |
| B、Al(OH)3胶体 |
| C、盐酸 |
| D、NaNO3溶液 |
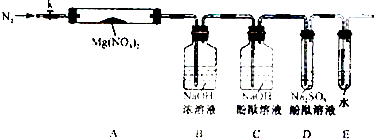 固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想: 在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中含有大量Mg2+、Al3+、Fe3+、Ag+、Ba2+等离子.试分析回答下列问题:
在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中含有大量Mg2+、Al3+、Fe3+、Ag+、Ba2+等离子.试分析回答下列问题: