题目内容
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,0.1NA个HCl分子的体积为2.24L |
| B、标准状况下,22.4L 氖气含有2NA 个原子 |
| C、1L 0.2mol/L 硫酸铁溶液中含有的SO42- 离子数目为0.2 NA |
| D、1 mol氖中含有的电子数为10NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.常温常压下,不是标准状况下,不能使用标况下的气体摩尔体积计算其体积;
B.稀有气体为单原子分子,1mol氖气中含有1mol氖原子;
C.根据n=cV计算出硫酸铁的物质的量,再根据硫酸铁的化学式计算出含有的硫酸根离子的物质的量;
D.氖气为单原子分子,1mol氖气中含有1mol氖原子,含有10mol电子.
B.稀有气体为单原子分子,1mol氖气中含有1mol氖原子;
C.根据n=cV计算出硫酸铁的物质的量,再根据硫酸铁的化学式计算出含有的硫酸根离子的物质的量;
D.氖气为单原子分子,1mol氖气中含有1mol氖原子,含有10mol电子.
解答:
解:A.不是标准状况下,不能使用标况下的气体摩尔体积计算氯化氢的体积,故A错误;
B.标准状况下,22.4L氖气的物质的量为1mol,1mol氖气中含有1mol氖原子,含有NA个原子,故B错误;
C.1L 0.2mol/L 硫酸铁溶液中含有0.2mol硫酸铁,含有0.6mol硫酸根离子,含有的SO42-离子数目为0.6NA,故C错误;
D.1mol氖中含有1mol氖原子,含有10mol电子,含有的电子数为10NA,故D正确;
故选D.
B.标准状况下,22.4L氖气的物质的量为1mol,1mol氖气中含有1mol氖原子,含有NA个原子,故B错误;
C.1L 0.2mol/L 硫酸铁溶液中含有0.2mol硫酸铁,含有0.6mol硫酸根离子,含有的SO42-离子数目为0.6NA,故C错误;
D.1mol氖中含有1mol氖原子,含有10mol电子,含有的电子数为10NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的综合应用,侧重考查了稀有气体的组成,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握物质的量与摩尔质量、物质的量浓度、阿伏伽德罗常数等物理量之间的转化关系.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
下列说法正确的是( )
| A、相同体积和物质的量浓度的不同溶液里所含溶质的物质的量相同 | ||
| B、10mol/L的浓盐酸与H2O等质量混合所得混合液的浓度为5mol/L | ||
C、溶液中溶质质量分数为w,密度为ρg?cm-3,溶质摩尔质量为Mg?mol-1的溶液的物质的量浓度为
| ||
| D、一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为0.1NA |
| B、0.1mol苯中含有双键的数目为0.3NA |
| C、标准状况下,22.4L乙醇中含有分子的数目为NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、常温常压下,8gO2含有2nA个电子 |
| B、10L0.1mol?L-1的氨水中有nA个NH4+ |
| C、标准状况下,22.4L盐酸含有nA个HCl分子 |
| D、1molNa与足量氧气反应生成Na2O和Na2O2的混合物,失去nA个电子 |
1g干冰(固态CO2)中含有氧原子a个,则阿伏加德罗常数可表示为( )
| A、22a | B、44a |
| C、44a/3 | D、14a |
能正确表示下列化学反应的离子方程式的是( )
| A、氢氧化钡溶液与盐酸的反应 2OH-+2H+=2H2O |
| B、钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
| C、铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
| D、碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
下表是五种银盐的溶度积常数(25℃),下列有关说法错误的是( )
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 5.0×10-13 | 8.3×10-17 |
| A、五种物质在常温下溶解度最大的是Ag2SO4 |
| B、向AgCl的悬浊液中加入0.1mol/L Na2S溶液,则可以生成黑色的Ag2S沉淀 |
| C、外界条件改变时,沉淀溶解平衡也会发生移动 |
| D、常温下,向AgI的悬浊液中加入0.1mol/L NaCl溶液,黄色沉淀变成白色沉淀 |
 (1)将反应2H2(g)+O2(g)=2H2O(1)△H<0,以KOH溶液为电解质溶液,设计一个原电池,其负极反应为:
(1)将反应2H2(g)+O2(g)=2H2O(1)△H<0,以KOH溶液为电解质溶液,设计一个原电池,其负极反应为: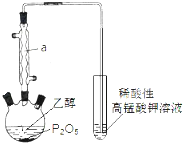 已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃.某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去).
已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃.某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去).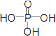 )
)