题目内容
20.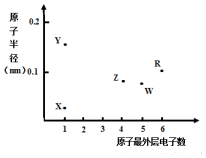 X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )
X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )| A. | 简单离子半径:Y<W | |
| B. | 最高价氧化物对应水化物的酸性:Z<W | |
| C. | R为氧元素 | |
| D. | X与Z可以形成正四面体结构的分子 |
分析 X、Y、Z、W、R为五种短周期元素,X、Y最外层只有一个电子,为第IA族元素;Z最外层有4个电子,位于第IVA族,W原子最外层有5个电子,位于第VA族,R最外层有6个电子,位于第VIA族;
Y原子半径最大,为Na元素,X原子半径最小,为H元素;Z原子和W原子半径接近、W原子半径大于Z而最外层电子数大于Z,所以Z是C、W是N、R为S元素;
A.离子电子层数越多其离子半径越大,当电子层数相同时,核电荷数越大,半径越小;
B.元素的非金属性越强,其最高价含氧酸的酸性越强;
C.R为S元素;
D.X、Z可以形成CH4.
解答 解:X、Y、Z、W、R为五种短周期元素,X、Y最外层只有一个电子,为第IA族元素;Z最外层有4个电子,位于第IVA族,W原子最外层有5个电子,位于第VA族,R最外层有6个电子,位于第VIA族;
Y原子半径最大,为Na元素,X原子半径最小,为H元素;Z原子和W原子半径接近、W原子半径大于Z而最外层电子数大于Z,所以Z是C、W是N、R为S元素;
A.Y离子为Na+,有两个电子层,而W离子为N3-,也有2个电子层,而当电子层数相同时,核电荷数越大,半径越小,故简单离子半径:Y<W,故A正确;
B.元素的非金属性越强,其最高价含氧酸的酸性越强,由于Z为C元素,而W为N元素,非金属性W更强,故最高价氧化物对应水化物的酸性:Z<W,故B正确;
C.由于R处于第VIA族,且半径大于Z和E,故R为硫元素,故C错误;
D.X、Z可以形成CH4,而甲烷是正四面体结构,故D正确.
故选C.
点评 本题考查原子结构和元素周期律,侧重考查学生推断及知识综合运用、灵活运用能力,明确离子半径比较方法、最高价含氧酸比较方法、物质结构是解本题关键,注意规律中的反常现象,题目难度不大.

练习册系列答案
相关题目
10.下列有机物命名正确的是( )
| A. | 2-乙基戊烷 | B. | 1-甲基丙醇 | C. | 二溴乙烷 | D. | 1,2,4-三甲苯 |
11.一种从植物中提取的天然化合物,可用于制作“香水”,其结构为: ,有关该化合物的下列说法错误的是( )
,有关该化合物的下列说法错误的是( )
 ,有关该化合物的下列说法错误的是( )
,有关该化合物的下列说法错误的是( )| A. | 分子式为C12H18O2 | |
| B. | 分子中至少有6个碳原子共平面 | |
| C. | 该化合物能使酸性高锰酸钾褪色 | |
| D. | 一定条件下,1mol该化合物最多可与3mol H2加成 |
8.下列关于钢管腐蚀与电化防护的说法正确的是( )
| A. | 钢管与电源正极连接,钢管不易被腐蚀 | |
| B. | 通常情况下,钢管的电化腐蚀主要是吸氧腐蚀 | |
| C. | 钢管与铜管露天堆放在一起,钢管不易被腐蚀 | |
| D. | 钢管发生析氢腐蚀时,负极反应是Fe-3e→Fe3+ |
15.最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)?4NH3 (g)+3O2(g)-Q(Q>0),如果反应的平衡常数K值变大,该反应( )
| A. | 一定向正反应方向移动 | |
| B. | 一定向逆反应方向移动 | |
| C. | 在平衡移动时正反应速率先减小后增大 | |
| D. | 在平衡移动时逆反应速率先增大后减小 |
4.现有A、B、C、D、E五种溶液分别是盐酸、醋酸、氢氧化钠溶液、氨水、碳酸钠溶液中的一种.常温下进行下列实验:
(1)A的溶质是Na2CO3,D的溶质是HC1,E的溶质是NaOH(均填化学式)
(2)将等体积、等物质的量浓度的D、E分别与足量的铝粉反应,相同条件下产生氢气的体积之比为1:3.
(3)将等体积、等物质的量浓度的B和C混合后所得溶液的PH为7,又己知醋酸的酸性强于碳酸,由此可推断碳酸氢铵水溶液呈碱(填“酸”、“碱”或“中”)性.
(4)将D溶液逐滴滴加到A溶液中,当滴入的D的物质的量与A相等时,溶液中所有阴离子的物质的量浓度由大到小的关系为c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-).
| 序号 | 实验步骤和结论 |
| ① | 比较浓度均为0.1mol•L-1的A和E的pH的大小为:7<A<E |
| ② | 1L pH=9的A分别与x L 0.001mol•L-1 B,y L 0.001mol•L-1D充分反应后,当溶液均呈中性时x、y的大小关系为:y<x; |
| ③ | pH=a的C与pH=b的D,且a+b=14,等体积混合发生酸碱中和反应后,溶液呈碱性. |
(2)将等体积、等物质的量浓度的D、E分别与足量的铝粉反应,相同条件下产生氢气的体积之比为1:3.
(3)将等体积、等物质的量浓度的B和C混合后所得溶液的PH为7,又己知醋酸的酸性强于碳酸,由此可推断碳酸氢铵水溶液呈碱(填“酸”、“碱”或“中”)性.
(4)将D溶液逐滴滴加到A溶液中,当滴入的D的物质的量与A相等时,溶液中所有阴离子的物质的量浓度由大到小的关系为c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-).
11. 肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
 肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )| A. | 电池工作时,正极附近的pH降低 | |
| B. | 当消耗1molO2时,有2molNa+由甲槽向乙槽迁移 | |
| C. | 负极反应为4OH-+N2H4-4e-=N2↑+4H2O | |
| D. | 若去掉离子交换膜电池也能正常工作 |
8.设NA为阿伏加德罗常败的数值,下列说法错误的是( )
| A. | 0.1 mol羟基 ( 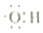 ) 中含有的电子数为0.7NA ) 中含有的电子数为0.7NA | |
| B. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA | |
| C. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COC-数目为NA | |
| D. | 14g乙烯与丙烯混合气体中的氢原子数为2NA |
9.已知单质碘受热易升华.从海带中提取碘的实验过程中涉及下列操作正确的是( )
| A. | 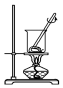 灼烧海带 | B. | 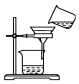 过滤得含I-的溶液 | ||
| C. | 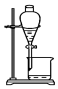 放出碘的苯溶液 | D. | 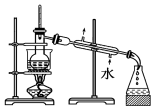 分离碘并回收苯 |