题目内容
11. 肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )| A. | 电池工作时,正极附近的pH降低 | |
| B. | 当消耗1molO2时,有2molNa+由甲槽向乙槽迁移 | |
| C. | 负极反应为4OH-+N2H4-4e-=N2↑+4H2O | |
| D. | 若去掉离子交换膜电池也能正常工作 |
分析 A、燃料电池的正极是氧气在正极发生还原反应生成氢氧根离子;
B、消耗1mol氧气转移4mol电子;
C、负极发生氧化反应,是肼在反应,注意电解质溶液的酸碱性即可;
D、若撤走阳离子交换膜后,肼会与水中溶解的氧气直接接触,发生爆炸.
解答 解:A、碱性环境中,氧气在正极发生还原反应生成氢氧根离子,pH增大,故A错误;
B、消耗1molO2时,有4molNa+由甲槽向乙槽迁移,故B错误;
C、燃料电池的负极发生氧化反应,是肼在反应,肼中的N从-2价升高到0价,碱性电池中,其电极反应式应为:N2H4+4OH--4e-=N2+4H2O,故C正确;
D、若撤走阳离子交换膜后,肼会与水中溶解的氧气直接接触,发生爆炸,无法工作,故D错误;
故选C.
点评 本题考查了燃料电池,为高频考点,侧重于学生的分析的考查,题目涉及电极反应式以及电池反应方程式书写,题目难度较大.

练习册系列答案
相关题目
2.等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,离子方程式正确的是( )
| A. | CO32-+Ba2+→BaCO3↓ | |
| B. | HCO3-+OH-→H2O+CO32- | |
| C. | HCO3-+Ba2++OH-=H2O+BaCO3↓ | |
| D. | 2HCO3-+Ba2++2OH-→BaCO3↓+2H2O+CO32- |
3.下表中,对陈述I、II的正确性及两者间是否具有因果关系的判断都正确的是( )
| 选项 | 陈述I | 陈述II | 判断 |
| A | 氢氧化铝可用于治疗胃酸过多 | Al(OH)3可与盐酸反应 | I对,II对,有 |
| B | SiO2可用作光导纤维 | SO2是良好的半导体 | I对,II对,有 |
| C | Al2O3作耐火材料 | Al2O3具有高熔点 | I对,II错,无 |
| D | HF可用来蚀刻玻璃 | HF是强酸 | I对,II对,无 |
| A. | A | B. | B | C. | C | D. | D |
20.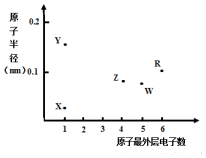 X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )
X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )
 X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )
X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )| A. | 简单离子半径:Y<W | |
| B. | 最高价氧化物对应水化物的酸性:Z<W | |
| C. | R为氧元素 | |
| D. | X与Z可以形成正四面体结构的分子 |
3.一些常见有机物的转化如图下列说法正确的是( )


| A. | 上述有机物中只有C6H12O6属于糖类物质 | |
| B. | 转化1可在人体内完成,该催化剂属于蛋白质 | |
| C. | 物质C和油脂类物质互为同系物 | |
| D. | 物质A和B都属于电解质 |
20.下列溶液中,与100ml 0.5mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
| A. | 100 ml 0.5 mol/L MgCl2 溶液 | B. | 200 ml 0.25 mol/L HCl溶液 | ||
| C. | 50 ml 1 mol/L NaCl溶液 | D. | 200 ml 0.25 mol/L CaCl2溶液 |
1.下列各物质中,所含分子数相同的是( )
| A. | 10gCH4和 10gO2 | B. | 11.2LN2(标准状况)和 11g CO2 | ||
| C. | 9 g H2O 和 0.5mol Cl2 | D. | 224mL H2(标准状况)和 0.1mol N2 |