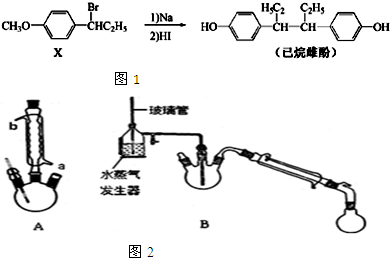
题目内容
7.纳米材料二氧化钛(TiO2)可做优良的催化剂.I.工业上氧化钛的制备方法:
①将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入清华路中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4
②将SiCl4分离,得到纯净的TiCl4.
③在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O.
④TiO2•xH2O高温分解得到TiO2.
(1)根据资料卡片中信息判断,分离TiCl4与SiCl4的混合物所采取的操作名称是蒸馏.
(2)③中反应的化学方程式是TiCl4+(x+2)H2O $\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
Ⅱ.据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2.其过程大致如下:
a.O2→2O b.O+H2O→2OH c.OH+OH→H2O2
(3)b中破坏的是极性共价键(填“极性共价键”或“非极性共价键”)
(4)H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的氧化性 (填“氧化性”或“还原性”).
Ⅲ.某研究小组用下列装置模拟“生态马路”清除CO的原理.(夹持装置已略去)
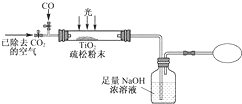
(5)如缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为37.5%.
(6)当CO气体全部通入后,还要通一会儿空气,其目的是将残留在装置中的CO2气体排出,被NaOH溶液吸收,减小误差.
分析 (1)根据资料卡片中的TiCl4与SiCl4熔点、沸点判断TiCl4与SiCl4在常温下的状态,分离沸点相差较大的互溶液体常采取蒸馏方法;
(2)由信息可知TiCl4与水在加热条件下,水解得到沉淀TiO2•xH2O与HCl;
(3)由2O+H2O→2OH,可知水中O-H键断裂.非金属元素之间一般形成极性键;
(4)CxHy、CO等具有还原性,H2O2具有强氧化性;
(5)NaOH溶液增重16.5g为吸收的CO2质量,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为$\frac{16.5g}{44g/mol}$=0.375mol,依据转化率概念计算得到;
(6)装置中有残留的二氧化碳气体,通一会空气的目的是赶净装置中 的二氧化碳被氢氧化钠吸收,减少测定误差.
解答 解:(1)根据资料卡片中的TiCl4与SiCl4熔点、沸点可知,TiCl4与SiCl4在常温下的状态是液态,分离沸点相差较大的互溶液体常采取蒸馏方法,
故答案为:蒸馏;
(2)由信息可知TiCl4与水在加热条件下,水解得到沉淀TiO2•xH2O与HCl,反应方程式为:TiCl4+(x+2)H2O $\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl,
故答案为:TiCl4+(x+2)H2O $\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl;
(3)由2O+H2O→2OH,可知水中O-H键断裂,O-H键属于极性共价键,故答案为:极性共价键;
(4)CxHy、CO等具有还原性,H2O2具有强氧化性,H2O2能氧化CxHy、CO等,清除路面空气中的CxHy、CO等,故答案为:氧化性;
(5)22.4L(已折算成标准状况)CO气体的物质的量为 $\frac{22.4L}{22.4L/mol}$=1mol,NaOH溶液增重16.5g为吸收的CO2质量,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为$\frac{16.5g}{44g/mol}$=0.375mol,所以CO的转化率为$\frac{0.375mol}{1mol}$×100%=37.5%,故答案为:37.5%;
(6)装置中有残留的CO2气体,通一会儿空气,将残留在装置中的CO2气体排出,被NaOH溶液吸收,减小误差,
故答案为:将残留在装置中的CO2气体排出,被NaOH溶液吸收,减小误差.
点评 本题考查学生阅读题目获取信息能力、物质分离提纯等基本操作、对实验原理装置的理解等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.

| A. | ②中水的电离程度的是①的8倍 | |
| B. | ①和③中水的电离程度相等 | |
| C. | 等体积的①和④混合后所得溶液中:c(NH3•H2O)<c(NH4+) | |
| D. | ②中水的电离程度等于④ |
| A. | ①③④ | B. | ①④⑥ | C. | ②③⑤ | D. | ③⑤⑥ |
| A. | A和B的转化率均是20% | B. | x=4 | ||
| C. | 平衡时A的物质的量为3.2mol | D. | 平衡时气体压强比原来减小 |


 .
.