题目内容
15.某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物和探究溴乙烷的性质.(一)溴乙烷的制备及产物的检验:设计了如图1装置,其中夹持仪器、加热仪器及冷却水
管没有画出.请根据实验步骤,回答下列问题:
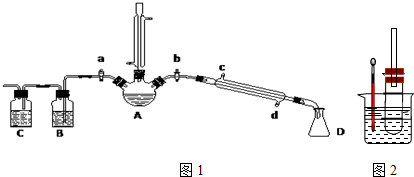
(1)仪器A中除了加入上述物质外,还需加入沸石.
(2)制备操作中,加入少量的水,其目的是abc(填字母).
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(3)上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等.
①检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验.B、C中应盛放的试剂分别是a、d(填字母).
a.苯 b.水 c.NaOH 溶液 d.硝酸银溶液
②检验副产物中是否含有乙醚:通过红外光谱仪鉴定所得产物中含有“-CH2CH3”基团,来确定副产物中存在乙醚.该同学的方案不正确(选填“正确”或“不正确”),理由是溴乙烷中也含乙基.
(4)欲除去溴乙烷中的少量杂质Br2,最佳方法是d(填字母).
a.KI溶液洗涤 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)溴乙烷性质的探究:
某同学用右图装置(铁架台、酒精灯等未画出)来探究溴乙烷的性质.
(1)在试管中加入10mL 6mol•L-1 NaOH水溶液和5mL 溴乙烷,水浴加热.当观察到液体不分层现象时,表明溴乙烷与NaOH水溶液已完全反应.该反应的化学方程式为CH3CH2Br+H2O$\stackrel{NaOH}{→}$CH3CH2OH+HBr.
(2)在试管中加入10mL饱和 NaOH乙醇溶液和5mL 溴乙烷,水浴加热.为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,需要检验的是生成的气体,检验的方法是将生成的气体先通过盛有水的试管,再通入盛有酸性KMnO4溶液的试管,酸性KMnO4溶液褪色(或直接通入溴的四氯化碳溶液,四氯化碳褪色)(用简要的文字说明).
分析 (一)(1)圆底烧瓶中除了加药品外还应加沸石;
(2)加入水可以降低浓硫酸浓度,减少副反应的发生;减少溴的挥发;减少溴化氢的挥发等;
②溴乙烷中也含乙基;
(3)①B装置除去干扰物质溴;C装置检验溴化氢;
②溴乙烷中也含乙基,故此同学的判断错误
(4)根据溴乙烷和溴的性质,逐一分析能够和溴化氢反应且不能和溴乙烷反应试剂,注意除杂不能引进新的杂质;
(二)(1)实验检验溴乙烷再碱性条件下水解反应,反应生成乙醇与NaBr,反应完毕溶液不再分层;溴乙烷与NaOH水溶液反应生成乙醇和溴化钠;
(2)溴乙烷在NaOH乙醇溶液中发生消去反应,生成乙烯,乙烯能够使酸性的高锰酸钾褪色(或者使溴的四氯化碳褪色),只要证明乙烯的存在即可证明发生的是消去反应
解答 解:(一)(1)圆底烧瓶中除了加药品外还应加沸石;
故答案为:沸石;
(2)反应中加入少量的水,防止反应进行时发生大量的泡沫,减少副产物乙醚的生成和避免HBr的挥发,故abc正确,故选abc;
(3)①检验溴化氢,可用硝酸银溶液,但先要除去混有的溴,所以要加入苯,选a,将混合物通过有机溶剂,再通入硝酸银溶液,若有浅黄色沉淀,说明有溴化氢产生,所以选d,
故答案为:a;d;
②由于溴乙烷中也含乙基,故该同学的判断不正确,故答案为:不正确;溴乙烷中也含乙基;
(4)a.KI和溴单质反应,但生成的碘单质会混入,故a错误;
b.溴单质和氢氧化钠反应,溴代烷也和NaOH溶液中水解反应,故b错误;
c.溴乙烷和Br2都能溶于四氯化碳,故c错误;
d.溴单质和Na2SO3溶液发生氧化还原反应,可以除去溴单质,故d正确;故答案为:d;
(二)(1)实验检验溴乙烷再碱性条件下水解反应,反应生成乙醇与NaBr,液体不再分层,表明溴乙烷与NaOH溶液已完全反应,溴乙烷与NaOH水溶液反应生成乙醇和溴化钠,反应方程式为CH3CH2Br+H2O$\stackrel{NaOH}{→}$CH3CH2OH+HBr,
故答案为:液体不分层;CH3CH2Br+H2O$\stackrel{NaOH}{→}$CH3CH2OH+HBr;
(2)溴乙烷在NaOH乙醇溶液中发生消去反应,生成乙烯,只有证明乙烯的存在即可证明发生的是消去反应,即证明生成的气体,方法是:将生成的气体先通过盛有水的试管,再通入盛有酸性KMnO4溶液的试管,酸性KMnO4溶液褪色(或直接通入溴的四氯化碳溶液,四氯化碳褪色),
故答案为:生成的气体;将生成的气体先通过盛有水的试管,再通入盛有酸性KMnO4溶液的试管,酸性KMnO4溶液褪色(或直接通入溴的四氯化碳溶液,四氯化碳褪色).
点评 本题考查了卤代烃的结构和性质,题目难度中等,注意溴乙烷发生取代反应,生成乙醇与氢溴酸;发生消去反应,生成乙烯和氢溴酸,抓住不同条件下生成的不同产物的性质是设计实验的关键.

| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| ① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| ② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| ③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| ④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| ⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| ⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| ⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| ⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| ⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
| ⑩ | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
(2)下列数据推断正确的是AD
A.t1<70 B.t1>t4 C.m1<m2 D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是CuSO4与Zn反应产生的Cu,Cu与Zn形成铜锌原电池,加快了H2产生的速率.
(4)硫酸的物质的量浓度是2.4mol/L,实验⑥生成的硫酸锌的质量m5=9.9g.
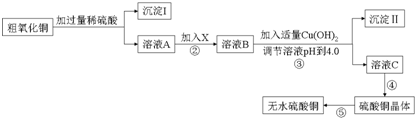
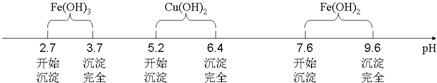
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
请回答下列问题:
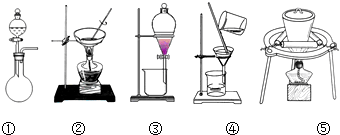
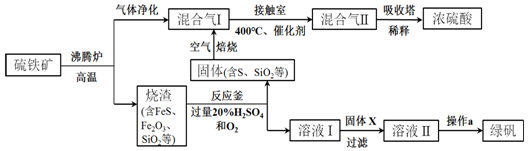
(1)在整个实验过程中,下列实验装置不可能用到的是①③(填序号)
(2)物质X应选用②(填序号)
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(3)从溶液C中制取硫酸铜晶体的实验操作为蒸发浓缩 冷却结晶、过滤、自然干燥.
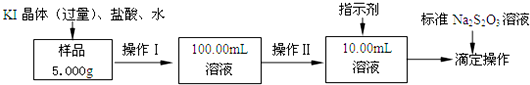
(4)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度.过程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL.
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质.
(已知2Cu2++4I-=2CuI↓+I2)
第三步:以淀粉溶液为指示剂,用0.05000mol•L-1的Na2S2O3标准溶液滴定,前后共测定三组.达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:(已知:I2+2S2O32-═2I-+S4O62-)
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
最后一滴试液滴入,溶液由蓝色变为无色,振荡半分钟,溶液无明显变化.
②溶液A中c(Cu2+)=0.5000mol/L.
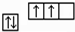 ;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.
;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.

 ;该反应的类型为取代.
;该反应的类型为取代.