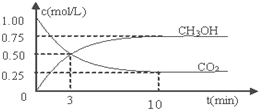
题目内容
16.在一定温度下,NO2和CO在催化剂作用下发生反应4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0,当反应达到平衡时,下列措施:①降温 ②恒容通入惰性气体 ③增加NO2浓度 ④加压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高CO转化率的是( )| A. | ①③④ | B. | ①④⑥ | C. | ②③⑤ | D. | ③⑤⑥ |
分析 化学反应4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0;是气体体积减小的反应,正向反应是放热反应;转化率的变化根据化学平衡的移动方向分析判断.
①降温平衡向放热反应方向移动;
②恒容通入惰性气体,各反应物的浓度不变;
③增加NO2的浓度,平衡正向进行;
④加压平衡向气体体积减小的方向进行;
⑤加催化剂,改变速率不改变平衡;
⑥恒压通入惰性气体,反应物的分压减小.
解答 解:化学反应4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0;是气体体积减小的反应,正向反应是放热反应;能提高CO转化率,则平衡正向移动,
①降温平衡向放热反应方向移动,即向正方向移动,则能提高CO转化率,故正确;
②恒容通入惰性气体,各反应物的浓度不变,化学平衡不移动,CO的转化率不变,故错误;
③增加NO2的浓度,平衡正向进行,能提高CO转化率,故正确;
④加压平衡向气体体积减小的方向进行,即向正方向移动,则能提高CO转化率,故正确;
⑤加催化剂,改变速率不改变平衡,CO的转化率不变,故错误;
⑥恒压通入惰性气体,反应物的分压减小,平衡向逆反应方向移动,CO的转化率减小,故错误.
故选A.
点评 本题考查化学平衡的移动,明确常见的影响因素结合信息中“提高CO转化率”即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
11.可逆反应N2+3H2?2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列各关系中能说明反应已达到最大限度(即化学平衡)的是( )
| A. | N2将完全转化为NH3 | |
| B. | N2、H2、和NH3的物质的量浓度相等 | |
| C. | N2、H2、和NH3的物质的量浓度不在变化 | |
| D. | 正反应和逆反应的速率都为零 |
1.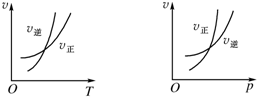 可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
 可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )| A. | m<n+p,Q>0 | B. | m>n+p,Q>0 | C. | m<n+p,Q<0 | D. | m>n+p,Q<0 |
 ,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
 ;该反应的类型为取代.
;该反应的类型为取代.