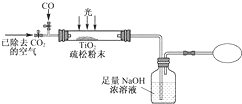
题目内容
2.某种磁铁矿主要成分是Fe3O4和SiO2,工业上利用该矿石冶炼金属铁和高纯硅,主要工艺流程如图所示(部分试剂和产物略):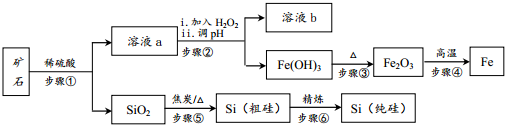
回答下列问题:
(1)下列关于Si或SiO2的叙述中,不正确的是C.
A.高纯单质Si是制造太阳能电池的重要材料
B.SiO2可用于制造光导纤维
C.SiO2是酸性氧化物,所以不溶于任何酸
(2)步骤①中发生反应的离子方程式为Fe3O4+8H+═Fe2++2Fe3++4H2O.
(3)步骤⑤中由SiO2制得Si(粗硅)的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;该反应的副产物可用于为生产流程中的步骤④提供原料(填步骤序号).
(4)粗硅中所含的杂质主要是过量的焦炭.
(5)用离子方程式表示步骤②中加H2O2的作用是H2O2+2Fe2++2H+═2Fe3++2H2O.
(6)若矿石中的铁元素全部转化为单质Fe,现有Fe3O4质量分数为58%的矿石200t,理论上最多能得到单质Fe的物质的量为1.5×106mol.
分析 磁铁矿主要成分是Fe3O4和SiO2,步骤①溶于稀硫酸,二氧化硅与酸不反应,四氧化三铁与酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O,步骤②加入过氧化氢氧化亚铁离子H2O2+2Fe2++2H+═2Fe3++2H2O,调节溶液的PH得到溶液b和铁离子沉淀,步骤③氢氧化铁受热分解2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O生成氧化铁,步骤④铝热反应2Al+Fe2O$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,生成铁,步骤⑤二氧化硅和焦炭反应制取粗硅SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,步骤⑥粗硅的提纯:硅和氯气反应Si+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4,生成四氯化硅,氢气在高温下与四氯化硅反应提纯粗硅,反应为SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl,得到纯硅.
(1)A.Si是重要的半导体材料;
B.SiO2是制造光导纤维的主要材料;
C.SiO2具有酸性氧化物的通性,但SiO2能与HF反应;
(2)四氧化三铁与盐酸反应生成亚铁离子、铁离子和水;
(3)晶体硅(Si)是一种重要的半导体材料.冶炼硅时常用碳在高温下还原二氧化硅制得粗硅;
(4)粗硅中所含的杂质主要是过量的焦炭;
(5)酸性溶液中过氧化氢具有氧化性,能氧化硫酸亚铁为硫酸铁,过氧化氢被还原为水;
(6)根据铁元素守恒计算.
解答 解:(1)A.硅在元素周期表中位于金属元素和非金属元素的分界线处,是良好的半导体,晶体硅可导电,晶体硅是目前应用最成熟、最广泛的太阳能电池材料太阳能电池材料,故A正确;
B.二氧化硅是制造光导纤维的主要材料,是利用了光全反射原理,故B正确;
C.SiO2 能与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O,故C错误;
故答案为:C;
(2)步骤①溶于稀硫酸,二氧化硅与酸不反应,四氧化三铁与酸反应,四氧化三铁与硫酸反应生成硫酸铁、硫酸亚铁和水,反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O,
故答案为:Fe3O4+8H+═Fe2++2Fe3++4H2O;
(3)步骤⑤二氧化硅和焦炭反应制取粗硅,碳在高温下还原二氧化硅制得粗硅,反应的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)步骤⑤制取粗硅气体产物为一氧化碳,需大量焦炭,所以粗硅中含有过量的焦炭,
故答案为:过量的焦炭;
(5)酸性条件下H2O2氧化硫酸亚铁生成硫酸铁和水,反应的离子方程式为:H2O2+2Fe2++2H+═2Fe3++2H2O;
故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
(6)若矿石中的铁元素全部转化为单质Fe,现有Fe3O4质量分数为58%的矿石200t,根据铁元素守恒,最多能得到单质Fe的物质的量为$\frac{200×1{0}^{6}×58%}{232}×3$=1.5×106mol.
故答案为:1.5×106.
点评 本题主要考查了铁、硅及其化合物的性质、阅读题目获取信息的能力等,掌握粗硅的提纯、铁的化合物的性质以及反应的书写方法是解答的关键,需要学生具备运用信息与基础知识分析问题、解决问题的能力,题目难度中等.

| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9m~10-7m之间 | |
| B. | 用平行光照射NaCl溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液与NaOH溶液混合,以制取Fe(OH)3胶体 | |
| D. | 除去Fe(OH)3胶体中的H+、Cl-,可用渗析的实验方法 |
| A. | N2将完全转化为NH3 | |
| B. | N2、H2、和NH3的物质的量浓度相等 | |
| C. | N2、H2、和NH3的物质的量浓度不在变化 | |
| D. | 正反应和逆反应的速率都为零 |
| 选项 | 参数 | 比较 | 解释 |
| A | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| B | 半径 | Na+>Al3+>S2- | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 还原性 | P3->S2->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| A. | A | B. | B | C. | C | D. | D |
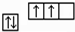 ;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.
;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.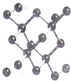
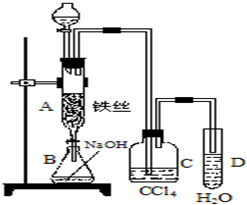 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.