题目内容
9.己知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是( )| A. | 0.03mol•L-1的蔗糖溶液 | B. | 0.03mol•L-1的BaCl2溶液 | ||
| C. | 0.04mol•L-1的NaCl溶液 | D. | 0.02mol•L-1的CH3COOH溶液 |
分析 根据溶液中非挥发性溶质的分子或离子数越多,该溶液的沸点就越高,则假设溶液为1L时计算选项中溶质的物质的量来比较即可解答.
解答 解:A.1L蔗糖溶液中蔗糖的物质的量为1L×0.03mol/L=0.03mol;
B.1LBaCl2溶液溶质的离子的总物质的量为1L×0.03mol/L×3=0.09mol;
C.1LNaCl溶液中溶质的离子的总物质的量为1L×0.04mol/L×2=0.08mol;
D.CH3COOH是挥发性溶质,且1L溶液中分子的物质的量为1L×0.02mol/L=0.02mol,则D不符合题意;
显然B中含0.09mol离子,离子数最多,
故选:B.
点评 本题考察角度新颖,利用非挥发性溶质的分子或离子数来判断溶液的沸点高低,学生熟悉物质的量浓度的有关计算是解答的关键,并会判断挥发性物质来解答即可.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
19.下列离子方程式正确的是( )
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
20.下列说法正确的是( )
| A. | 瓦斯中甲烷和氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为1:2 | |
| B. | 欲配制1.00 L1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 22.4LN2和H2的混合气体中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,得到8NA个电子 |
4.下列微粒不具有氧化性的是( )
| A. | Cl2 | B. | Cl- | C. | H+ | D. | Fe3+ |
14.下表中是各组反应的反应物和反应温度,反应刚开始时,放出H2速率最快的是( )
| 编号 | 金属(粉末状)(mol) | 酸的浓度及体积 | 反应温度(℃) | ||
| A | Al | 0.1 | 0.1mol•L-1 硫酸 | 10mL | 60 |
| B | Fe | 0.1 | 0.2mol•L-1盐酸 | 10mL | 60 |
| C | Al | 0.1 | 18mol•L-1 硫酸 | 10mL | 60 |
| D | Mg | 0.1 | 0.2mol•L-1 硝酸 | 10mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
12.实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸的浓度的实验.请完成下列填空:
(1)配制100mL 0.10mol•L-1 NaOH标准溶液.称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol•L-1(保留两位有效数字).
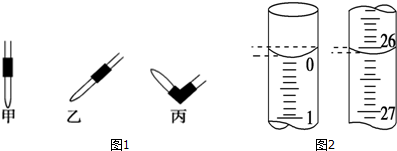
③排去碱式滴定管中气泡的方法应采用如图1所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④若滴定开始和结束时,碱式滴定管中的液面如图2所示,则起始读数为0.00 mL,终点读数为26.10 mL;所用NaOH溶液的体积为26.10 mL.
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有DE(填字母序号).
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
(1)配制100mL 0.10mol•L-1 NaOH标准溶液.称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液的浓度(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol•L-1(保留两位有效数字).

③排去碱式滴定管中气泡的方法应采用如图1所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④若滴定开始和结束时,碱式滴定管中的液面如图2所示,则起始读数为0.00 mL,终点读数为26.10 mL;所用NaOH溶液的体积为26.10 mL.
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有DE(填字母序号).
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
13.图是炭和水蒸汽发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应.下列说法不正确的是( )


| A. | 步骤1为吸热反应,步骤2为放热反应 | |
| B. | E2>E3>E1 | |
| C. | 1mol C发生该反应时吸收的能量为E3-E1 | |
| D. | E2-E1<E2-E3 |