题目内容
17.通过NOx传感器可监测NOx的含量,其工作原理示意图如图: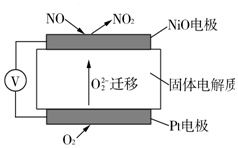
(1)Pt电极上发生的是还原(填“氧化”或“还原”)反应.
(2)写出NiO电极的电极反应式:NO+O2--2e-=NO2.
分析 (1)原电池中正极得电子的物质发生还原反应;
(2)NiO电极上NO失电子和氧离子反应生成二氧化氮.
解答 解:(1)装置无外接电源,故为原电池,铂电极上氧气得电子生成氧离子而被还原,所以为正极,发生还原反应,故答案为:还原;
(2)NiO电极上NO失电子和氧离子反应生成二氧化氮,NiO为负极,所以电极反应式为:NO+O2--2e-=NO2,故答案为:NO+O2--2e-=NO2.
点评 本题考查了原电池原理,根据O、N元素化合价变化判断正负极,再结合反应物、生成物及得失电子书写电极反应式,注意书写电极反应式时要结合电解质特点,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.化学已渗透到人类生活的各个方面,下列说法的错误是( )
| A. | 交警检查司机是否酒后驾车的原理中体现了乙醇的还原性 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| C. | 铜的金属活动性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| D. | 以石油、煤和天然气为原料通过聚合反应可以获得用途广泛的高分子合成材料 |
8.(1)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈紫红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(2)在100℃和200kPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
根据表中的数据,回答下列问题:
①压强从200kPa增加到500kPa时,平衡不移动(填“正向”“逆向”或“不”),理由是浓度增大的倍数和压强增大的倍数相同.
②压强从500kPa增加到1 000kPa时,平衡正向转移(填“正向”“逆向”或“不”),其原因可能是加压至1000kPa时,C物质变成了非气态物质.
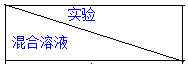 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈紫红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(2)在100℃和200kPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
| 压强(kPa) | 200 | 500 | 1 000 |
| B的浓度(mol•L-1) | 0.04 | 0.1 | 0.27 |
①压强从200kPa增加到500kPa时,平衡不移动(填“正向”“逆向”或“不”),理由是浓度增大的倍数和压强增大的倍数相同.
②压强从500kPa增加到1 000kPa时,平衡正向转移(填“正向”“逆向”或“不”),其原因可能是加压至1000kPa时,C物质变成了非气态物质.
5.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1L 0.1mol•L-1的纯碱溶液中含有0.1NA个Na+ | |
| B. | 常温常压下,23g NO2中含有NA个氧原子 | |
| C. | 常温常压下,22.4L CCl4含有个NACCl4分子 | |
| D. | 1molFe与足量的盐酸反应,转移3NA个电子 |
12.下列物质属于硅酸盐的是( )
| A. | 二氧化硅 | B. | 保鲜膜 | C. | 青花瓷 | D. | 金刚石 |
2.下列说法不正确的是( )
| A. | 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏符合节能减排的理念 | |
| B. | 自发反应也可能是熵减小的反应 | |
| C. | 二次电池放电过程中的反应属于自发反应 | |
| D. | 若C2H2的燃烧热为1300 kJ•mol-1,在其燃烧过程中每转移5NA个电子会放出1300 kJ的能量 |
9.己知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是( )
| A. | 0.03mol•L-1的蔗糖溶液 | B. | 0.03mol•L-1的BaCl2溶液 | ||
| C. | 0.04mol•L-1的NaCl溶液 | D. | 0.02mol•L-1的CH3COOH溶液 |
6.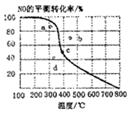 如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )
如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )
 如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )
如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )| A. | a | B. | b | C. | c | D. | d |
1.在中和滴定中,下列操作或说法不正确的是( )
| A. | 使用滴定管时,滴定管必须用待装液润洗2~3次 | |
| B. | 酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液 | |
| C. | 盛放准确量取待测液的锥形瓶应预先用待测液润洗 | |
| D. | 滴定操作应重复2至3次,并求出滴定用去的溶液体积的平均值,计算出待测液的浓度 |