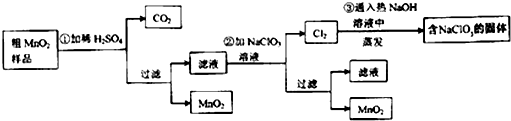
题目内容
19.下列离子方程式正确的是( )| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
分析 A.一水合氨为弱碱,应保留化学式;
B.三价铁离子能够氧化碘离子;
C.二者反应生成硝酸铜、一氧化氮和水;
D.原子个数守恒.
解答 解:A.向盐酸中滴加氨水,离子方程式:H++NH3•H2O═H2O+NH4+,故A错误;
B.Fe(OH)3溶于氢碘酸的离子反应为:2I-+2Fe(OH)3+6H+═2Fe2++6H2O+I2,故B错误;
C.铜溶于稀硝酸,离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故C正确;
D.Na2O2与H2O反应制备O2,离子方程式:2Na2O2+2H2O═4Na++4OH-+O2↑,故D错误;
故选:C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应考查,注意离子反应中保留化学式及电子、电荷守恒,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
10.下列叙述正确的是( )
| A. | 熵变小于零而焓变大于零的反应肯定不能自发发生 | |
| B. | 热化学方程式中△H的值与反应物的用量有关 | |
| C. | 化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,但反应前后物质的总能量不变 | |
| D. | 其他条件不变,增大反应物浓度是通过增大活化分子百分数,使化学反应速率加快 |
7.化学已渗透到人类生活的各个方面,下列说法的错误是( )
| A. | 交警检查司机是否酒后驾车的原理中体现了乙醇的还原性 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| C. | 铜的金属活动性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| D. | 以石油、煤和天然气为原料通过聚合反应可以获得用途广泛的高分子合成材料 |
11.碘是人体必需的微量元素之一.在市场中购买的加碘盐加入的是( )
| A. | I2 | B. | NaIO | C. | KI | D. | KIO3 |
8.(1)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈紫红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(2)在100℃和200kPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
根据表中的数据,回答下列问题:
①压强从200kPa增加到500kPa时,平衡不移动(填“正向”“逆向”或“不”),理由是浓度增大的倍数和压强增大的倍数相同.
②压强从500kPa增加到1 000kPa时,平衡正向转移(填“正向”“逆向”或“不”),其原因可能是加压至1000kPa时,C物质变成了非气态物质.
 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈紫红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(2)在100℃和200kPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
| 压强(kPa) | 200 | 500 | 1 000 |
| B的浓度(mol•L-1) | 0.04 | 0.1 | 0.27 |
①压强从200kPa增加到500kPa时,平衡不移动(填“正向”“逆向”或“不”),理由是浓度增大的倍数和压强增大的倍数相同.
②压强从500kPa增加到1 000kPa时,平衡正向转移(填“正向”“逆向”或“不”),其原因可能是加压至1000kPa时,C物质变成了非气态物质.
9.己知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是( )
| A. | 0.03mol•L-1的蔗糖溶液 | B. | 0.03mol•L-1的BaCl2溶液 | ||
| C. | 0.04mol•L-1的NaCl溶液 | D. | 0.02mol•L-1的CH3COOH溶液 |