题目内容
 钙的化合物在共农业生产和生活中有广泛的应用.
钙的化合物在共农业生产和生活中有广泛的应用.(1)已知CaC2与水反应生成乙炔,请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中反应生成红棕色Cu2C2沉淀,Cu+基态核外电子排布式为
②CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是
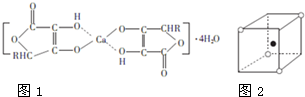
(2)离子化合物抗坏血酸钙的组成为Ca(C6H7O6)2?4H2O,其结构示意图如1:该物质中存在的化学键类型包括
A.金属键 B.离子键 C.非极性共价键 D.配位键
(3)CaF2晶体的最小单元如图2所示,密度为dg?cm-1,阿伏伽德罗常数的数值为NA,则晶体中两个距离最近的Ca2+中心间的距离为
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用
专题:化学键与晶体结构
分析:(1)①Cu为29号元素,Cu+的基态电子排布式为1s22s22p63s23p63d10;
②等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键;
③丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化;
(2)非金属元素之间形成共价键,金属离子与阴离子之间形成离子键,钙离子提供空轨道,O原子提供孤对电子,形成配位键;
(3)根据均摊法计算出晶胞中原子数目,根据m=ρV列式计算.
②等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键;
③丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化;
(2)非金属元素之间形成共价键,金属离子与阴离子之间形成离子键,钙离子提供空轨道,O原子提供孤对电子,形成配位键;
(3)根据均摊法计算出晶胞中原子数目,根据m=ρV列式计算.
解答:
解:(1)①Cu为29号元素,要注意3d轨道写在4s轨道的前面同时还有就是它的3d结构,Cu+的基态电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
②根据等电子体原理可知,O22+的电子式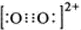 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,故答案为:
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,故答案为: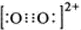 ;2NA;
;2NA;
③丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化;构成丙烯腈的元素中,电负极性最小的是H,同一周期元素第一电离能从左到右逐渐增大,电离能最大的是N;故答案为:sp、sp2;H;N;
(2)非金属元素C、O,C、H之间形成共价键,金属离子与阴离子之间形成离子键,钙离子提供空轨道,O原子提供孤对电子,形成配位键,故答案为:BCD;
(3)氟离子的数目为1,钙离子的数目为4×
=
,设晶体中两个距离最近的Ca2+中心间的距离为x,则晶胞边长为
cm,一个晶胞的质量为
g,根据m=ρV,
=d(
)3,解得x=
.故答案为:
.
故答案为:1s22s22p63s23p63d10;
②根据等电子体原理可知,O22+的电子式
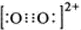 ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,故答案为:
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,故答案为: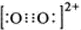 ;2NA;
;2NA;③丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化;构成丙烯腈的元素中,电负极性最小的是H,同一周期元素第一电离能从左到右逐渐增大,电离能最大的是N;故答案为:sp、sp2;H;N;
(2)非金属元素C、O,C、H之间形成共价键,金属离子与阴离子之间形成离子键,钙离子提供空轨道,O原子提供孤对电子,形成配位键,故答案为:BCD;
(3)氟离子的数目为1,钙离子的数目为4×
| 1 |
| 8 |
| 1 |
| 2 |
| x | ||
|
19+40×
| ||
| NA |
19+40×
| ||
| NA |
| x | ||
|
| 2 |
| 3 |
| ||
| 2 |
| 3 |
| ||
点评:本题考查物质结构与性质,熟悉物质的物理性质及物质的成键即可解答,难度较大,注重学生对信息的处理,较好的考查学生分析问题、解决问题的能力.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
在一密闭容器中有如下反应:aX(g)+bY(g)?nW(g)△H,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:其中,φ(W)表示W在反应混合物中的体积分数,t表示反应时间.当其他条件不变时,下列分析正确的是( )


| A、图Ⅰ可能是不同压强对反应的影响,且p1>p2,a+b<n |
| B、图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b |
| C、图Ⅱ可能是在同温同压下不同催化剂对反应的影响,且1使用的催化剂效果好 |
| D、图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 |
常温下,用 0.10mol?L-1 NaOH溶液分别滴定20.00mL 0.10mol?L-1 HCl溶液和20.00mL 0.10mol?L-1 CH3COOH溶液,得到2条滴定曲线,如图所示,则下列说法正确的是( )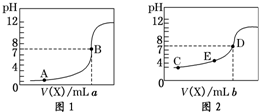

| A、图2是滴定盐酸的曲线 |
| B、a与b的关系是:a<b |
| C、E点对应离子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙 |










