题目内容
2.已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为1s22s22p63s23p63d104s24p3,该元素的符号是As;
(2)Y元素原子的价层电子的电子排布图为
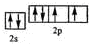 ,该元素的名称是氧;
,该元素的名称是氧;(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O;
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性,并说明理由稳定性NH3>PH3>AsH3,键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定.
分析 X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意,然后结合原子结构与性质来解答.
解答 解:X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意,综上所述,故X为As元素、Y为氧元素、Z为氢元素.
(1)由上述分析可知,X为As;,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3.
故答案为:1s22s22p63s23p63d104s24p3;As;
(2)Y为O元素,名称为氧,原子基态时的电子排布式为1s22s22p4,其价电子的轨道表示式为 ,
,
故答案为: ;氧;
;氧;
(3)X为As元素、Y为氧元素,Z为氢元素.化合物X2Y3为As2O3,XZ3为AsH3,As2O3在稀硫酸溶液中可被金属锌还原为AsH3,产物还有ZnSO4和H2O,反应中Zn元素化合价由0价升高为+2价,As元素化合价由+3价降低为-3价,参加反应的Zn与As2O3的物质的量之比为6×2:2=6:1,反应方程式为As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O,
故答案为:As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O.
(4)X为As元素,AsH3与NH3、PH3中,键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定,所以稳定性NH3>PH3>AsH3.
故答案为:稳定性NH3>PH3>AsH3,键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、电子排布推断元素、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素周期律、元素化合物知识的应用,题目难度不大.

| A. | 1mol•L-1的NaCl溶液中含NA个Cl- | |
| B. | 标准状况下,11.2LCCl4中含有0.5NA个分子 | |
| C. | 同温同压下,2NA个C2H4(g)与NA个C4H8(g)的密度不相等 | |
| D. | 64gSO2与足量的O2充分反应后得到NA个SO3分子 |
| A. | 甲醛浸泡的海产品 | |
| B. | 霉变的大米、花生 | |
| C. | 用亚硝酸钠(NaNO2)代替食盐烹调的食品 | |
| D. | 食盐腌制的咸鸭蛋 |
| A. | 绿色荧光蛋白分子中氨基酸排列顺序一定相同 | |
| B. | 绿色荧光蛋白能发生颜色反应及盐析、变性等 | |
| C. | 绿色荧光蛋白可发生水解反应生成多种氨基酸 | |
| D. | 绿色荧光蛋白可用于跟踪生物细胞的分子变化 |
| A. | 化合反应 | B. | 复分解反应 | C. | 分解反应 | D. | 取代反应 |
| A. | 标准状况下,11.2 L水中含有的氢氧键数为NA | |
| B. | 250 mL 1 mol•L-1FeCl3溶液中,阴、阳离子总数为NA | |
| C. | 一定条件下,将1mol SO2和0.5 mol O2充入一密闭容器内,充分反应后的生成物分子数为NA | |
| D. | 在反应2Na2O2+2CO2═2Na2CO3+O2中,每生成0.5 molO2转移的电子数为NA |
| A. | 单质氧化性:I2>Br2>Cl2 | B. | 热稳定性:PH3>H2S>HCl | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |
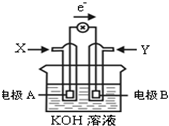 如图为某种甲醇燃料电池示意图,工作时电子流向如图所示.下列判断正确的是( )
如图为某种甲醇燃料电池示意图,工作时电子流向如图所示.下列判断正确的是( )| A. | X为氧气 | |
| B. | 电极A反应式:CH3OH-6e-+H2O=CO2+6H+ | |
| C. | B电极附近溶液pH增大 | |
| D. | 电池工作时,溶液中电子由电极B流向电极A |